题目内容
【题目】欲测定盐酸与氯化钙的混合溶液中氯化钙的质量分数,进行了如下实验:取混合溶液100g于锥形瓶中,向其中逐渐加入一定溶质质量分数的碳酸钠溶液(如图一),并不断测定锥形瓶中溶液的pH.反应过程中所得溶液的pH与锥形瓶中物质的总质量的关系如图二所示。其中,当锥形瓶中溶液的质量增加至147.8g时,共消耗碳酸钠溶液的质量为50g。(忽略二氧化碳在水中溶解的量;氯化钙溶液显中性。)
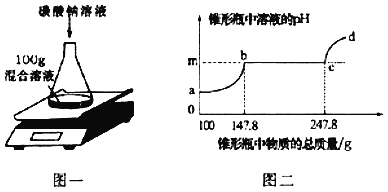
(1)m点的数值是_____。
(2)a→b段表示碳酸钠与混合溶液中的_____反应。
(3)参加反应的碳酸钠溶液的溶质的质量分数是_____。
(4)请计算原混合溶液中CaCl2的质量分数为_______(写计算过程)。
【答案】 7 碳酸钠与混合溶液中的盐酸反应 10.6% 11.1%
【解析】根据图可以看出碳酸钠先和盐酸反应然后和氯化钙反应,所以m对应的pH为7;a→b为碳酸钠与混合溶液中的盐酸反应;根据此段的质量变化求算碳酸钠溶液的溶质质量分数,进而计算氯化钙的质量分数。(1)根据图可以看出碳酸钠先和盐酸反应然后和氯化钙反应,所以m对应的pH为7;(2)a→b为碳酸钠与混合溶液中的盐酸反应;(3)a→b段质量变化为生成的二氧化碳,所以生成的二氧化碳的质量为100g+50g﹣147.8g=2.2g
设参加反应的碳酸钠溶液的溶质的质量分数为x。
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
50g*x 2.2g
![]()
x=10.6%
而和氯化钙反应的碳酸钠溶液的质量为247.8g﹣147.8g=100g
设原混合溶液中CaCl2的质量分数为y。
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106
100g*y 100g×10.6%
![]()
y=11.1%
答:(1)m点的数值是7;(2)a→b段表示碳酸钠与混合溶液中的盐酸反应;(3)参加反应的碳酸钠溶液的溶质的质量分数是10.6%;(4)原混合溶液中CaCl2的质量分数为11.1%。

 名校课堂系列答案
名校课堂系列答案【题目】小明通过实验证明二氧化碳能与氢氧化钠反应,并检验生成了碳酸盐。
25℃时,氢氧化钠和碳酸钠在乙醇中的溶解度如下表所示。
物质 | NaOH | Na2CO3 |
溶解度/g | 17.3 | <0.01 |
利用如图所示装置进行实验(该装置气密性良好;乙醇不参与反应)。
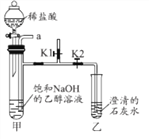
[步骤1]打开K1,关闭K2,从a口通入二氧化碳,看到饱和氢氧化钠的乙醇溶液中产生大量沉淀,停止通二氧化碳;
[步骤2]从a口通入氮气,直至排净装置中的二氧化碳;
[步骤3]关闭K1,打开K2,向甲装置的试管中滴入足量的稀盐酸。
(1)步骤1装置甲的试管中能看到沉淀的原因是______。
(2)步骤2中,排净装置甲中二氧化碳的目的是______。
(3)步骤3乙中能看到的现象是________,反应的化学方程式是_______。