题目内容
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线,请根据溶解度曲线回答下列问题:
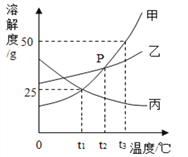
(1)t 3 ℃ 时,将 30g 甲物质加入到 50g 水中,充分溶解后所得溶液的质量为______g。
(2)当甲中含有少量乙时,提纯甲的方法是_________。
(3) t 3 ℃ 时等质量的甲、乙、丙三种物质的饱和溶液降温至 t 1 ℃,所得溶液中溶质的质量分数由大到小的顺序为__________________。
【答案】 75 冷却甲的热饱和溶液或冷却结晶或降温结晶 乙、甲、丙
【解析】(1)t3℃时,将30g甲物质加入到50g水中,100g水中能溶解50g甲。所以50g水中最多能溶解25g甲。充分溶解后所得溶液的质量=25g+50g=75g;(2)当甲中含有少量乙时,提纯甲的方法是:降温结晶(或冷却热饱和溶液),因为甲的溶解度受温度的影响变化比乙大;(3)图像中的温度变化,需要找到图中点进行平移。图像中的温度变化,需要找到图中点进行平移。平移后,超过溶解度的需要降低到溶解度的位置,并析出晶体,低于溶解度的不变。t3℃时等质量的甲、乙、丙三种物质的饱和溶液降温至t1℃,由于甲、乙的溶解度减小并都是该温度下的饱和溶液且乙大于甲,所以乙的溶质质量分数大于甲的;由于丙的溶解度增大,其溶质质量分数不变但小于甲的。

 阅读快车系列答案
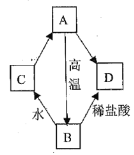
阅读快车系列答案【题目】我国西北地区有很多咸水湖,其中最大的是柴达木盆地的察尔汗盐池。某盐湖附近的农民通过“冬天捞碱,夏天晒盐”获得大量湖盐。小伟同学取该湖盐样品进行探究。
(提出问题)该湖盐样品的成分是什么?
(查阅资料)冬天捞碱的“碱”指Na2CO3,夏天晒盐的“盐”指NaCl。
(猜想与假设)猜想一:Na2CO3
猜想二:NaCl
猜想三:Na2CO3和NaCl
(实验探究)
实验 | 实验操作 | 实验现象 | 实验结论 |
实验一 | 取少量样品于试管中,加适量水溶解后,加入过量稀HNO3 | 产生能使澄清石灰水变浑浊的气体 | ①猜想_____不成立 |
实验二 | ②向实验一所得的溶液中加入适量的_____ | ③_____ | 猜想三成立 |
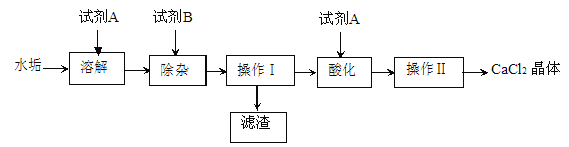
(拓展延伸)为进一步确定该湖盐样品中Na2CO3的质量分数,小伟同学再取该湖盐样品10.00g做了如图所示的补充实验。
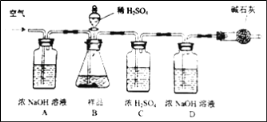
(1)反应结束之后通入空气的目的是_____。
(2)装置A中浓NaOH溶液的作用是_____(用方程式表示)。
(3)实验结束后测得装置D增重0.44g,则湖盐样品中Na2CO3的质量分数为_____%(保留一位小数)。
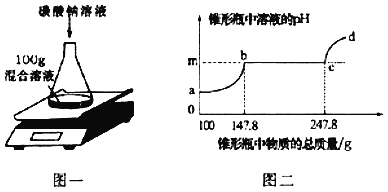
【题目】根据大量的实验总结得出酸碱盐之间相互发生复分解反应的条件是:生成物中有沉淀、气体或水。依据该条件,某化学小组的同学推断稀硫酸和氯化镁溶液不能发生复分解反应。为了进一步确认该推断的可靠性,该小组同学将一定量稀硫酸和一定量氯化镁溶液在烧杯中混合后,进行了如下探究活动。
(1)甲同学取烧杯中混合溶液分别进行以下两个实验,记录实验现象如下。请依据实验现象填写实验结论:
实验 | 实验现象 | 实验结论 |
| 溶液变红 | 溶液中含有_____(写离子符号) |
| 产生白色沉淀 | 溶液中含有_____(写离子符号) |
(甲同学的结论)稀硫酸与氯化镁溶液没有发生反应 | ||
(2)乙同学看到甲同学的实验报告后,认为甲同学的结论不正确,原因是_____。为了进一步确认两者没发生反应,还需检验烧杯内的混合液中是否含有氯化镁。于是,乙同学设计了如下两个实验:
①取少量烧杯内的混合液于试管中,逐滴加入过量的_____溶液,证明了混合液中含有Mg2+.整个实验过程中乙同学观察到的实验现象是_____。
②乙同学另取少量烧杯内的混合液,通过实验成功地检验出混合液中含有Cl﹣.他设计的方案为_____(写出操作和现象)。
(总结)通过上述实验,该小组同学证明了稀硫酸和氯化镁溶液确实没有发生反应。
【题目】已知相同条件下,气体的体积比即其分子个数比。一定条件下,下表所示的物质在密闭的容器内充分反应,测得反应前后各物质的质量如下表:
物质 | X | 氧气 | 水 | 二氧化碳 | 一氧化碳 |
反应前质量/g | 3.2 | 11.2 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | a |
(1)相同条件下该反应生成的CO与CO2的质量比为________;体积比为________。
(2)若要使X充分燃烧,还需增加的氧气的质量为__________。