题目内容
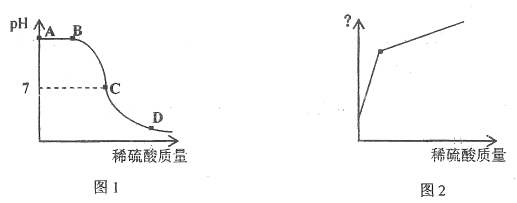
【题目】某恒温容器中盛有NaOH饱和水溶液且仍有部分NaOH固体剩余,向容器中缓慢滴加稀硫酸,经测定,溶液pH随加入稀硫酸质量的变化如图1所示,(已知溶液中![]() 浓度越大,溶液碱性越强;
浓度越大,溶液碱性越强;![]() 浓度越大,溶液酸性越强)
浓度越大,溶液酸性越强)
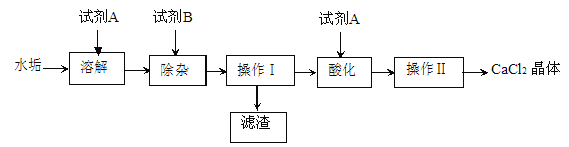
(1)写出实验过程中发生反应的化学方程式_____________
(2)从A点到B点过程中,溶液所含溶液NaOH的质量____(填“不变”或“变大”或“变小”)。
(3)写出D点对应溶液的溶质__________(填化学式)。
(4)图2中纵坐标可表示________(填序号)。
①溶剂质量 ②溶液质量 ③NaOH溶质质量分数
【答案】 2NaOH + H2SO4 ==Na2SO4 + 2H2O 变大 Na2SO4 和H2SO4 ①②
【解析】(1)稀硫酸与氢氧化钠反应生成硫酸钠和水,反应方程式为2NaOH + H2SO4 ==Na2SO4 + 2H2O。(2)因为容器中盛有NaOH饱和水溶液且仍有部分NaOH固体剩余,当加入稀硫酸时,溶剂质量增多,没有溶解的NaOH固体继续溶解,所以从A点到B点过程中,溶液所含溶质NaOH的质量变大。(3)D点溶液的pH<7,溶液显酸性,稀硫酸剩余,故溶液中的溶质有生成的Na2SO4及剩余的H2SO4。(4)①加入稀硫酸时,溶剂质量增多,增多的质量是生成水的质量和稀硫酸中水的质量的总和,当氢氧化钠完全反应后,溶剂增多的质量是稀硫酸中溶剂的质量,故反应过程中溶剂质量增加的快,正确;②加入稀硫酸时,由于溶剂质量增多,没有溶解的NaOH固体继续溶解,溶液增加的质量是溶解的NaOH固体的质量与加入稀硫酸的质量之和,当NaOH固体完全溶解后,溶液增加的质量等于加入的稀硫酸的质量,正确;③随着稀硫酸的加入,溶液中NaOH的质量逐渐减少到零,错误。故选①②。

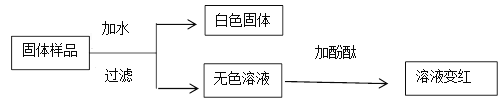
【题目】根据大量的实验总结得出酸碱盐之间相互发生复分解反应的条件是:生成物中有沉淀、气体或水。依据该条件,某化学小组的同学推断稀硫酸和氯化镁溶液不能发生复分解反应。为了进一步确认该推断的可靠性,该小组同学将一定量稀硫酸和一定量氯化镁溶液在烧杯中混合后,进行了如下探究活动。
(1)甲同学取烧杯中混合溶液分别进行以下两个实验,记录实验现象如下。请依据实验现象填写实验结论:
实验 | 实验现象 | 实验结论 |
| 溶液变红 | 溶液中含有_____(写离子符号) |
| 产生白色沉淀 | 溶液中含有_____(写离子符号) |
(甲同学的结论)稀硫酸与氯化镁溶液没有发生反应 | ||
(2)乙同学看到甲同学的实验报告后,认为甲同学的结论不正确,原因是_____。为了进一步确认两者没发生反应,还需检验烧杯内的混合液中是否含有氯化镁。于是,乙同学设计了如下两个实验:
①取少量烧杯内的混合液于试管中,逐滴加入过量的_____溶液,证明了混合液中含有Mg2+.整个实验过程中乙同学观察到的实验现象是_____。
②乙同学另取少量烧杯内的混合液,通过实验成功地检验出混合液中含有Cl﹣.他设计的方案为_____(写出操作和现象)。
(总结)通过上述实验,该小组同学证明了稀硫酸和氯化镁溶液确实没有发生反应。
【题目】某化学兴趣小组对酸、碱、盐的部分性质进行探究。
(探究一)氢氧化钠与二氧化碳反应
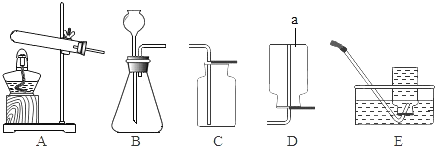
甲同学设计实验方案如图1所示
(1)实验现象为______,甲同学由此判断氢氧化钠和二氧化碳发生了反应。
(2)小组内其他同学认为甲同学方案不完善,理由是______。
(探究二)氢氧化钠和盐酸发生中和反应时放出热量。
乙同学向一定量10%的氢氧化钠溶液中滴加10%的盐酸,滴加过程中温度变化如表
加入盐酸体积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
混合溶液温度 T/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
(3)反应的化学方程式为_____。
(4)根据表中数据分析混合溶液温度变化的原因_____。
(5)小组内其他同学提出“将10%的盐酸直接滴入氢氧化钠固体中也能得出相同结论”,你认为是否合理并说明理由_____。
(6)丙同学将甲同学和乙同学实验后的溶液混合,未发现明显现象。现将混合液中的氯化钠进行提纯,具体的操作为______。
(探究三)碳酸钠溶液与稀盐酸的分步反应
(查阅资料)向碳酸钠溶液中逐滴加入稀盐酸的反应是分步反应,第一步反应生成碳酸氢钠和氯化钠,当碳酸钠反应完后才发生第二步反应。
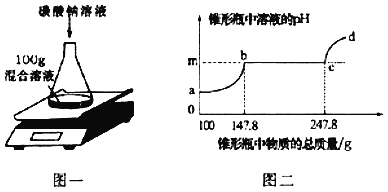
丁同学向106g质量分数为10%的碳酸钠溶液中逐滴加入质量分数为3.65%的稀盐酸,生成二氧化碳的质量变化如图2所示(不考虑CO2的溶解)。
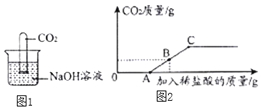
(7)A→C段发生反应的化学方程式为____。
(8)若B点横坐标为150,则其纵坐标为________。