题目内容
【题目】石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4g石灰石样品,把20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
稀盐酸的用量 | 5g | 5g | 5g | 5g |
剩余固体的质量 | 3g | 2g | 1g | 1g |
(1)该石灰石样品中碳酸钙的质量分数是;
(2)计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%).
(3)第三次加入5g稀盐酸后所得溶液的质量为 。
【答案】
(1)75%
(2)14.6%
(3)16.68g
【解析】(1)由题中的信息可知与盐酸反应的物质为碳酸钙,剩余部分为杂杂质,故碳酸钙的质量分数为![]() ×100%=75%;
×100%=75%;
(2)设盐酸的质量分数为x, 生成CO2为z
CaCO3+ | 2HCl═ | CaCl2+H2O+ | CO2↑ |
100 | 73 | 111 | 44 |
3g | 15g×x | y | z |
![]() =
=![]() x=14.6%;
x=14.6%;![]() =
=![]() z=1.22g;
z=1.22g;
答:该稀盐酸的溶质质量分数是14.6%;
(3)第三次加入5g稀盐酸后所得溶液的质量为15g+3g-1.22g=16.68g.
故答案为:(1)75%;(2)14.6%;(3)16.68g.
(1)由于样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水,因此第三次、第四次实验所剩余的固体就是杂质的质量,用样品的质量减去杂质的质量再除以样品的质量再乘以100%即为石灰石样品中碳酸钙的质量分数;
(2)写出碳酸钙和盐酸反应的化学方程式,由参加反应的碳酸钙的质量计算盐酸完全反应时消耗的HCl的质量,计算该稀盐酸的质量分数;根据实验数据,前三次所加入的稀盐酸都完全发生了反应,在计算稀盐酸的溶质质量分数时可使用前三次的实验数据.
(3)根据质量守恒定律解答即可.

【题目】小明在做铁与硫酸溶液反应的实验时,发现生成的气体有刺激性气味,于是进行了探究。
【提出问题】铁与硫酸溶液反应生成的气体为什么有刺激性气味?
【查阅资料】①6H2SO4(浓)+2Fe ![]() Fe2(SO4)3+6 H2O +3SO2↑
Fe2(SO4)3+6 H2O +3SO2↑
②SO2可使品红溶液的红色褪去。
【进行猜想】铁与不同浓度的硫酸溶液反应,生成的气体产物中可能有二氧化硫。
(1)【实验探究】小明用图甲所示的装置进行实验,并将E中收集到的气体进行如图乙所示的爆鸣实验。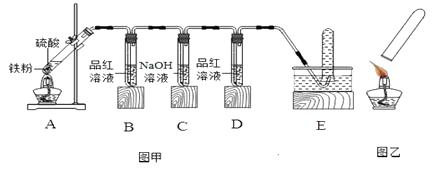
请帮助小明完成下表:
A中硫 | 实验现象 | A中生成气体成分 | |||
B中品 | D中品 | 爆鸣实验 | |||
实验一 | 98% | 褪色 | 不褪色 | 无爆鸣声 | 只有SO2 |
实验二 | 45% | 稍有褪色 | 不褪色 | 有爆鸣声 | |
实验三 | 25% | 不褪色 | 只有H2 | ||
【实验结论】铁与不同浓度的硫酸溶液反应,生成的气体产物可能不同,当硫酸浓度达到足够大时,生成的气体产物中有二氧化硫。
(2)【交流反思】①写出实验三中铁与硫酸反应的化学方程式:。
②实验一中C装置中反应的化学方程式:。
(3)【拓展延伸】在初中化学教材中也有反应物浓度不同,生成的产物不同的例子