题目内容
【题目】金属及金属材料在生产、生活中有广泛的应用。
(1)近年来,我国多地纷纷开展文明城市创建工作,垃圾分类回收是其中一项重要举措。某市街道垃圾桶如图所示,请回答下列问题:
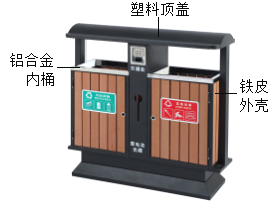
①中标识的物质,属于金属材料的是_____(写出一种即可)。
②使用铝合金做内筒的优点是_____(写出一点即可)。某品牌饮料的空易拉罐应收入_____(填“可回收”或“不可回收”)筒中。
③铁制品锈蚀的过程,实际上是铁跟空气中的_____发生化学反应的过程;除去铁制品表面的铁锈可用稀盐酸,反应的化学方程式为_____。但是时间稍长就会有少量气泡产生,反应的化学方程式为_____。
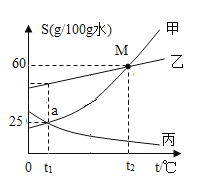
(2)将甲、乙、丙三种金属分别投入稀硫酸中,甲、丙表面有气泡产生,乙无明显现象;若将甲放入丙的硫酸盐溶液中,一段时间后,甲的表面有丙析出。由此推断这三种金属的活动性由强到弱的顺序是_____。
(3)将一定质量的铁粉加入到![]() 、
、![]() 、
、![]() 三种物质的溶液中,充分反应后过滤,得到滤液和滤渣。下列有关说法正确的是_____(填字母)。
三种物质的溶液中,充分反应后过滤,得到滤液和滤渣。下列有关说法正确的是_____(填字母)。
A 若滤液为蓝色,则滤渣中一定有银,可能有铜
B 若滤渣中含有银、铜、铁,则滤液中一定含有![]() 、
、![]() 、
、![]()
C 若滤液为浅绿色,则滤渣中一定含有银、铜、铝
D 若滤渣中加稀盐酸无气泡产生,则滤液中一定有![]() 、
、![]() 、
、![]() ,可能有
,可能有![]()
【答案】铁质外壳(或铝合金内筒) 抗腐蚀性强 可回收 水和氧气 ![]() Fe+2HCl=FeCl2+H2↑ 甲>丙>乙 A
Fe+2HCl=FeCl2+H2↑ 甲>丙>乙 A
【解析】
解:(1)①属于金属材料的是铁质外壳或是铝合金内筒;
②铝制品抗腐蚀性强,故使用铝合金做内筒的优点是抗腐蚀性强;空易拉罐应收入可回收筒中;
③铁制品锈蚀实际上是铁跟空气中的水和氧气发生化学反应的过程;除去铁制品表面的铁锈可用稀盐酸,反应的化学方程式为Fe2O3+6HCl═2FeCl3+3H2O;
(2)将甲、乙、丙三种金属分别投入稀硫酸中,甲、丙表面有气泡产生,乙无明显现象,说明乙的活动性最弱;若将甲放入丙的硫酸盐溶液中,一段时间后,甲的表面有丙析出,说明甲的活动性强于丙,故由此推断这三种金属的活动性由强到弱的顺序是甲>丙>乙;
(3)将一定质量的铁粉加入到Al(NO3)3、Cu(NO3)2、AgNO3三种物质的混合溶液中,则铁能与硝酸银反应,能与硝酸铜反应,不与硝酸铝反应,充分反应后过滤,得到滤液和滤渣;
A、若滤液为蓝色,则含有铜离子,则滤渣中一定有银,可能有铜,正确;
B、若滤渣中含有银、铜、铁,则滤液中一定含有Al3+和Fe2+、NO3-,错误;
C、若滤液为浅绿色,则滤渣中一定含银,不一定含有铜,不会含有铝,错误;
D、若滤渣中加稀盐酸无气泡产生,则滤液中一定有Al3+、Fe2+,可能有Ag+和Cu2+,错误。

【题目】密闭容器中,下列各组物质在一定条件下充分反应后,冷却至室温,密闭容器中的气态物质为纯净物的是( )
A.分子数比为1:1的![]() 和
和![]() B.物质的量比为4:3的
B.物质的量比为4:3的![]() 和
和![]()
C.质量比为1:5的![]() 和
和![]() D.质量比为3:8的
D.质量比为3:8的![]() 和
和![]()
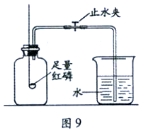
【题目】某同学用如下装置,进行有关碳及其氧化物的实验(图中夹持仪器已略去)。
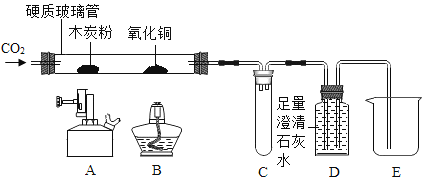
在完成气密性检查后加入药品,并已设法在玻璃管中充满二氧化碳。
实验步骤 | 实验现象 | 实验分析 |
①缓缓通入CO,点燃A处酒精喷灯,一段时间 | 木炭粉减少,D中有气泡、石灰水变浑浊且_____ | 玻璃管中反应的化学方程式_____,D中反应的化学方程式_____ |
②接下来点燃B处酒精灯,一段时间 | B处玻璃管内_____ | 实验说明_____具有还原性 |
③夹上弹簧夹停止通CO2,熄灭A、B火焰 | C中_____ | / |
有同学认为该装置需要添加尾气处理装置,你认为是否需要并说明理由_____。