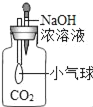
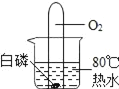
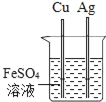
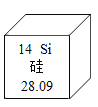
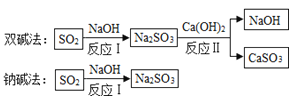题目内容
【题目】用质量相等的锌粉和铁粉,分别与等质量、相同浓度的稀硫酸充分反应,产生氢气的质量和反应所用时间的关系如图所示
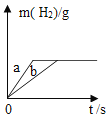
(1)曲线___________(填a或b)表示锌与稀硫酸的反应情况;
(2)完全反应后,消耗硫酸的质量_________________(填“相等”或“不相等”);
(3)反应后,有一种金属剩余,则该金属是_____________。
(4)写出锌和稀硫酸反应的化学方程式_______________。
【答案】a 相等 铁(或Fe) Zn+H2SO4=ZnSO4+H2↑
【解析】
铁和稀硫酸反应生成硫酸亚铁和氢气,锌和稀硫酸反应生成硫酸锌和氢气。
(1)锌的活动性比铁的活动性强,等质量的金属,锌反应的时间短,故曲线a表示锌与稀硫酸的反应情况。
(2)由图象可知,质量相等的锌粉和铁粉和等质量、相同浓度的稀硫酸完全反应后生成氢气的质量相等,则消耗硫酸的质量相等。
(3)65的锌和硫酸反应生成2份的氢气,56份的铁和硫酸反应生成2的氢气,生成等质量的氢气,金属铁反应的质量小,反应后,有一种金属剩余,则该金属是铁。
(4)锌与硫酸反应生成硫酸锌和氢气,反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑。

练习册系列答案
相关题目