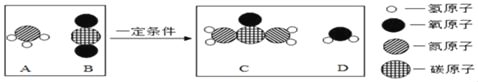
��Ŀ����
����Ŀ�������У�ʹ�õ�ʳ�ü��Ҫ�ɷ���̼���ƣ������������������Ȼ��ƣ���ѧ��ȤС���ͬѧ�������չ��̽��������ʵ��Ĺ��̺�������ͼ��ʾ��
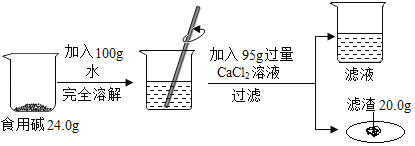
�����ͼ
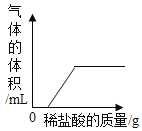
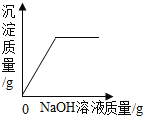
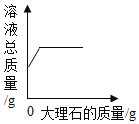
��1����Ӧ����Һ�к��е�������_____��д��ѧʽ��
��2��ͨ����֪���ݣ������������_____��д��ĸ��ţ�
a��Ӧ����Һ��������
b�μӷ�Ӧ���Ȼ��Ƶ�����
c��Ʒ��̼���Ƶ�����
d�Ȼ�����Һ�����ʵ���������
��3������ʳ�ü���Ʒ̼���Ƶ���������_____��д��������̣����������0.1%��
���𰸡�CaCl2��NaCl abc 87.9%
��������
��1���Ȼ�����ʣ�࣬���Եõ���Һ����ʣ����Ȼ��ƺ����ɵ��Ȼ��ơ���Ӧ�Ļ�ѧʽΪ��CaCl2��NaCl��
��2����Ӧ����Һ������=24.0g+100g+96g��20.0g��200g��ͨ����֪���ݣ��������Ӧ����Һ����������
�裺�μӷ�Ӧ���Ȼ��Ƶ�����Ϊx����Ʒ��̼���Ƶ�����Ϊy��
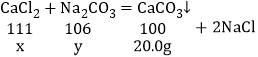
![]() x��22.2g��ͨ����֪���ݣ�������μӷ�Ӧ���Ȼ��Ƶ�������
x��22.2g��ͨ����֪���ݣ�������μӷ�Ӧ���Ȼ��Ƶ�������
![]() y��21.2g��ͨ����֪���ݣ��������Ʒ��̼���Ƶ�������
y��21.2g��ͨ����֪���ݣ��������Ʒ��̼���Ƶ�������
�ݸ��������ݽ��з�����֪���Ȼ���Ϊ�����ģ����������ݻ�ѧ����ʽ�����Ȼ�����Һ�����ʵ�������������ѡabc��
��3��ʳ�ü���Ʒ̼���Ƶ���������![]() ��
��

 ��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�����Ŀ��ij��ѧ����Χ��������кͷ�Ӧ������ѧ���ֳ�����С�鿪չ̽��������������һ���������ʵ��̽�������������пո�
����ʾʵ�飩��һ������ϡH2SO4���뵽ʢ��NaOH��Һ��С�ձ��С��÷�Ӧ�Ļ�ѧ����ʽΪ______��
��������⣩ʵ����δ�۲쵽����������ͬѧ���������ʣ���Ӧ����Һ��������ʲô��
����������裩������ʣ���ҷ�������롣����ͬѧ�IJ������£����㲹�ϲ����ġ�
����һ��ֻ��Na2SO4
���������Na2SO4��H2SO4
����������Na2SO4��H2SO4��NaOH
�����ģ�______��
����ͬѧ�����ϲ���������ɣ���Ϊ��һ�ֲ����Dz������ġ���ָ���������IJ��벢˵�����ɣ�______��
��ʵ��̽����
��1������ͬѧȡ�ձ��е���Һ�������Թ��У��μӼ���CuSO4��Һ�������Ա仯����Һ��һ��û��______��
��2��Ϊ����֤������룬��ѧϰС�������ձ��е���Һ����ѡ������ʦ�ṩ��pH��ֽ��Na2CO3��Һ��BaC12��Һ��������������������̽���������ʵ�鱨�棺
ʵ�鷽�� | ����Һ��pH | �μ�Na2CO3��Һ | �μ�BaC12��Һ |
ʵ����� |
|
|
|
ʵ������ | ��ֽ��ɫ���Աȱ�ɫ����pH��7 | ______ | ������ɫ���� |
ʵ����� | ��Һ����H2SO4 | ��Һ����H2SO4 | ��Һ����H2SO4 |
���ó����ۣ�ͨ��̽����ȫ��ͬѧһ��ȷ�����������ȷ�ġ�
�����۷�˼����1����ʦ��ͬѧ�����ö��ַ�������̽�������ҵó���ȷ���۸����˿϶���ͬʱָ��[ʵ��̽��]��2���д����������Դ������ҷ�˼��ͬѧ�Ǿ�����˼������������������
��ʵ������еĴ�����______��
��ʵ�鷽����Ҳ��һ���Ǵ���ģ������ԭ����______��
��2���ڷ�����Ӧ��������Һ�����ʳɷ�ʱ�����˿����������⣬����Ҫ����______��
����Ŀ��С��ͬѧ���»���ˮ��ͷ����˵�������˽��ˮ��ͷ��ͭ�ʶƸ��������С����̽������Cr���볣����������ͭ�Ļ��ǿ����������һͬ�μӡ�
��֪ʶ�طţ�
�������˳��K Ca Na Mg Al Zn_____Sn Pb��H��_____ Hg Ag Pt Au�������ں�������д��Ӧ������Ԫ�ط��š�
���������룩
����1��Cr��Fe��Cu������2��Fe��Cu��Cr�� ����3����IJ�����_____��
���������ϣ�
��1����������ɫ�й���Ľ������ڿ���������������ɿ���ʴ�����ܵ�����Ĥ��
��2��������ϡ���ᷴӦ��������ɫ�������Ǹ���CrSO4����Һ��
�������ʵ�飩
С��ͬѧȡ��С��ȵ����ֽ���Ƭ����ɰֽ��ĥ��������ȡ��֧�Թܣ��ֱ���������ͬ��ϡ���ᡣ
ʵ�� | �Թ�1 | �Թ�2 | �Թ�3 |
ʵ�� ���� |
|
|
|
ʵ�� ���� | ��Ƭ����������ݽ�������Һ��Ϊ_____ɫ | ��Ƭ����������ݽϿ죬��Һ���Ϊ_____ɫ | _____ |
����������ͣ�
��1��С�ϵõ��Ľ����Dz���_____��ȷ��
��2��ʵ��ǰ��ɰֽ��ĥ����Ƭ��Ŀ����_____��
��֪ʶ���ã�
����ƬͶ��FeSO4��Һ�У���Ӧ_____����ܡ����ܡ������С����ܽ��У�����д����Ӧ�Ļ�ѧ����ʽ_____��