题目内容
【题目】保险粉(化学式为Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定,在NaCl存在下,Na2S2O4在水中溶解度显著下降.制备流程如图:
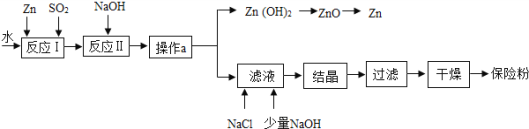
(1)反应Ⅰ的原理为:Zn+2SO2═ZnS2O4,该反应中将锌研磨成粉末的目的:_____;该反应的基本反应类型为_____.
(2)反应Ⅱ为复分解反应,该反应的化学方程式为_____.
(3)操作a得到的滤液有些浑浊,可能的原因_____.
(4)滤液中含有Na2S2O4,为使Na2S2O4结晶析出还需要加入少量NaOH的原因是_____,加入NaCl的原因是_____.
(5)氢氧化锌在加热的条件下分解成两种氧化物,写出氢氧化锌分解的化学方程式:_____
(6)198gZn(OH)2理论上能得到Zn的质量为_____g.
【答案】增大反应物的接触面积,加快反应,使反应更充分 化合反应 2NaOH+ZnS2O4=Zn(OH)2↓+Na2S2O4 滤纸破损或液面高于滤纸的边缘或仪器不干净 Na2S2O4在碱性溶液中稳定 Na2S2O4在水中溶解度显著下降 Zn(OH)2![]() ZnO+H2O 130g
ZnO+H2O 130g
【解析】
(1)反应中将锌研磨成粉末可以增大反应物的接触面积,加快反应,使反应更充分;该反应的反应物是两种,生成物是一种,属于化合反应;
(2)反应Ⅱ为复分解反应,则ZnS2O4与氢氧化钠溶液交换成分反应生成氢氧化锌沉淀和Na2S2O4,该反应的化学方程式为ZnS2O4+2NaOH═Zn(OH)2↓+Na2S2O4;
(3)若过滤得到滤液仍然浑浊,则可能的原因有:滤纸破损或液面高于滤纸的边缘或仪器不干净等;
(4)滤液中含有Na2S2O4,Na2S2O4在碱性溶液中稳定,在中性和碱性溶液中极不稳定,则为使Na2S2O4结晶析出还需要加入少量NaOH的原因是可调节溶液为碱性,使 Na2S2O4结晶稳定存在;NaCl的存在使Na2S2O4的溶解度显著下降;
(5)氢氧化锌在加热的条件下分解成氧化锌和水,化学方程式:Zn(OH)2![]() ZnO+H2O ;
ZnO+H2O ;
(6)由质量守恒定律,反应前后锌元素的质量不变,198gZn(OH)2理论上能得到Zn的质量为198g×![]() ×100%=130g。
×100%=130g。

 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案