题目内容
【题目】绿水青山就是金山银山,保护环境人人有责。请回答:
(1)目前人们利用最多的能源是煤、石油和______等化石燃料。煤燃烧会产生二氧化碳、二氧化硫、一氧化碳等气体,这些气体中,溶于雨水会形成酸雨的是______。科学家正在努力开发和利用的新能源有______、地热能、潮汐能等。
(2)新能源电池路灯被越来越广泛地应用。如图所标示的路灯各主要部件中属于有机合成材料的是______(填序号)。
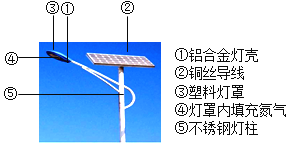
(3)铝合金灯壳在空气中具有强抗腐蚀性的原因______(用化学方程式表示)。
(4)铜丝能作导线是利用了铜的______性。
【答案】天然气 二氧化硫 太阳能 ④ 4Al+3O2=2Al2O3 导电
【解析】
(1)目前人们利用最多的能源是煤、石油和天然气等化石燃料。煤燃烧会产生二氧化碳、二氧化硫、一氧化碳等气体,这些气体中,溶于雨水会形成酸雨的是二氧化硫。科学家正在努力开发和利用的新能源有太阳能、地热能、潮汐能等。故填:天然气;二氧化硫;太阳能;
(2)有机合成材料包括塑料、合成纤维和合成橡胶,故填:④;
(3)在常温下,铝能与空气中氧气反应生成致密的氧化铝保护膜;故填:4Al+3O2=2Al2O3;
(4)铜具有导电性,可以制成导线;故填:导电。

【题目】取一定量氯化镁溶液于烧杯中,将100g的氢氧化钠溶液平均分成五次加入烧杯中。在化学反应过程中对烧杯中的溶液和沉淀进行了多次过滤并称量。加入的氢氧化钠溶液和生成沉淀的质量关系记录如下表。
实验次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
加入的氢氧化钠溶液质量/g | 20 | 20 | 20 | 20 | 20 |
沉淀总质量/g | 2.9 | 5.8 | 8.7 | 11.6 | 11.6 |
分析上表中的数据,完成下列问题:
(1)第_____次加完氢氧化钠溶液时,氯化镁和氢氧化钠恰好完全反应,此时生成沉淀质量为_____g。
(2)恰好完全反应时,称量所得氯化钠溶液质量为168.4g,则原氯化镁溶液中溶质的质量分数是____(请写出计算过程)。
【题目】除去下列各特质中的少量杂质,所有除杂试剂及操作方法均正确的是
特质 | 杂质(少量) | 加入试剂及用量 | 除杂操作方法 | |
A |
|
| 过量的 | 过滤,除去滤渣 |
B |
|
| 过量的稀硫酸 | 过滤,洗涤、干燥滤渣 |
C |
|
| 过量的铜粉 | 过滤,洗涤、干燥滤渣 |
D |
|
| 过量的氧化铜 | 加热 |
A. AB. BC. CD. D