题目内容
【题目】实验室以某石灰石(含少量Fe2O3)为原料制备高纯CaCO3的步骤如下。
溶解:向石灰石样品中加入适量盐酸,至反应完全。
除铁:加入氨水调节pH,然后加入适量Ca(OH)2,充分反应后过滤。
沉淀:向滤液中补充氨水,通入CO2,反应一段时间。
分离:过滤、洗涤、干燥得高纯CaCO3。
(1)溶解时,CaCO3、Fe2O3分别与盐酸反应的化学方程式为_____、_____。判断样品已完全反应的实验现象是_____。
(2)除铁时,选用Ca(OH)2而不选用NaOH,其主要原因是Ca(OH)2价格低且来源广、_____、_____;过滤所得滤渣的主要成分为_____。
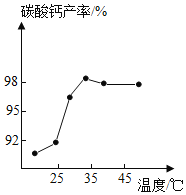
(3)沉淀时,其他条件相同,反应温度对CaCO3产率的影响如图。高于35℃时,CaCO3产率下降的主要原因是_____、_____。(已知:![]() ×100%)
×100%)
(4)分离时,若向过滤所得滤液中加入_____ (填化学式)并加热,则可回收NH3。
(5)该实验中可以循环利用的物质有H2O和_____。
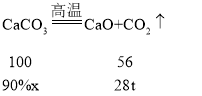
(6)石灰厂煅烧石灰石生产CaO,若要得到28t CaO,则至少需要含CaCO3 90%的石灰石____吨。(写出计算过程,保留一位小数。)
【答案】CaCO3+2HCl═CaCl2+H2O+CO2↑ Fe2O3+6HCl═2FeCl3+3H2O 加入盐酸,无气体生成 碱性弱 不引入新的杂质 氢氧化铁 氨水浓度降低 二氧化碳溶解能力降低 Ca(OH)2 CO2 55.6
【解析】
(1)溶解时,CaCO3、Fe2O3分别与盐酸反应的化学方程式为: CaCO3+2HCl═CaCl2+H2O+CO2↑、Fe2O3+6HCl═2FeCl3+3H2O;判断样品已完全反应的实验现象是:加入盐酸,无气体生成。
(2)除铁时,选用Ca(OH)2而不选用NaOH,氢氧化钙和氢氧化钠相比,价格低,来源广,且碱性弱,另外由于最终要制取碳酸钙,如果用NaOH会带进钠离子,而Ca(OH)2不引入新的杂质,所以选Ca(OH)2而不选用NaOH其主要原因是:Ca(OH)2价格低且来源广、碱性弱、不引入新的杂质;根据滤液最终转化为碳酸钙,可知过滤过程中除去的是铁元素对应的化合物,第一步反应生成氯化铁,这一步又加入Ca(OH)2,反应中应该生成氢氧化铁,且其难溶于水,所以过滤所得滤渣的主要成分为:氢氧化铁。
(3)沉淀时,其他条件相同,反应温度对CaCO3产率的影响图中高于35℃时,CaCO3产率下降,因为气体的溶解度随温度升高而下降,所以主要原因是:氨水浓度降低、二氧化碳溶解能力降低。
(4)分离时,所得滤液中含有氯化铵,由于铵根离子遇到可溶性碱生成氨气,可以选择加入碱,由于整个流程制备碳酸钙,加入氢氧化钙便于后期综合回收利用,所以向过滤所得滤液中加入Ca(OH)2并加热,则可回收NH3。
(5)开始二氧化碳是生成物,后来是反应物,所以该实验中可以循环利用的物质有除H2O外,还有:CO2。
(6)解:设若要得到28t CaO,则至少需要含CaCO3 90%的石灰石的质量为x
![]()
X=55.6t
答:至少需要含CaCO3 90%的石灰石的质量为55.6 t。