题目内容
【题目】现有家用食用碱12g(主要成分Na2CO3,其它成分不与酸反应),向其中加入某未知浓度的稀盐酸100g,恰好完全反应,剩余物质的总质量为107.6g,反应过程如图所示,请计算:
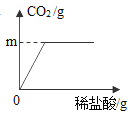
(1)该图中,m的值为____;
(2)该稀盐酸中溶质的质量分数为_____.
【答案】4.4 7.3%
【解析】
根据质量守恒定律可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳的质量和对应的化学方程式求算碳酸钠和HCl的质量,进而求算对应的质量分数.
(1)根据质量守恒定律,二氧化碳的质量为:100g+12g-107.6g=4.4g;图中m的值为4.4;
(2)设稀盐酸中氯化氢的质量分数为x
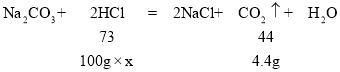
![]()
x=7.3%
该稀盐酸中溶质的质量分数为7.3%

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目