题目内容
【题目】海水中镁的总储量约为2.1×1015 t,可用于生产金属镁,目前世界生产的镁60%来自海水。利用海水提取镁的工业流程如图所示。
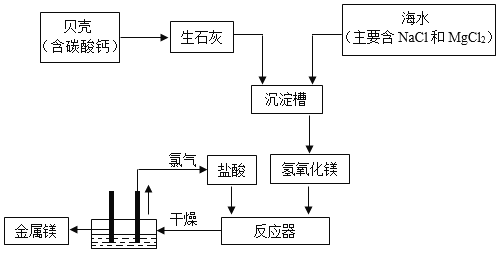
(1)沉淀槽中的化合反应的方程式是______________。
(2)电解槽中发生反应为:MgCl2![]() Mg+Cl2↑,若制得24kg金属镁,至少需要MgCl2的质量为______kg。
Mg+Cl2↑,若制得24kg金属镁,至少需要MgCl2的质量为______kg。
(3)请写出反应器中发生中和反应的化学方程式_________。
(4)在上述流程中,元素化合价没有发生变化的是_____。
【答案】CaO+H2O=Ca(OH)2 95kg 2HCl+Mg(OH)2═MgCl2+2H2O O、H、Ca、C
【解析】
(1)沉淀槽中发生的反应氧化钙和水反应生成氢氧化钙,属于化合反应,化学方程式为:CaO+H2O=Ca(OH)2;
(2)设:至少需要MgCl2的质量为x。

![]() x=95kg;
x=95kg;
(3)盐酸和氢氧化镁反应生成氯化镁和水,该反应是酸和碱反应生成盐和水,属于中和反应,反应的化学方程式为:2HCl+Mg(OH)2═MgCl2+2H2O;
(4)通过分析上述反应流程,元素化合价没有发生变化的是:O、H、Ca、C。

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目