题目内容
【题目】碳元素是构成物质种类最多的一种元素,许多物质都与我们的生活息息相关。
①金刚石、石墨、足球烯都是碳的单质,碳元素都以_______态存在,它们互称为碳元素的_____;其中,可做干电池里的碳棒的是________,可用于切割大理石的是_________。
②大气中二氧化碳增多的“功”与“过”:Ⅰ.二氧化碳增多为植物______________作用提供了足够的原料,是近年来农作物丰收的原因之一;Ⅱ.二氧化碳增多造成_______,使气候异常,给人类带来了灾难;
a.写出工业上高温煅烧石灰石产生二氧化碳的化学方程式___________;
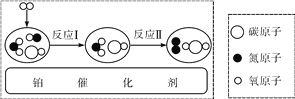
b.研究人员利用镍和钯作催化剂,将二氧化碳转化为具有多种用途的一氧化碳或甲醇。该转化属于_____________ (填“物理”或“化学”)变化,其中催化剂“镍和钯”是两种________(填“金属”或“非金属”);
c.有人提出设想:将排放到空气中的二氧化碳液化后压入到冰冷的深海中,但也有人担
心海水富含二氧化碳后酸度会增加,对海洋生物和海床等有危害。其中酸度增加的原理是(用化学方程式表示)__________;二氧化碳在冰冷的深海中溶解度比在通常状况下水中的溶解度_______(填“增大”、“减小”或“不变”),理由是 _________ 。
③城市煤气中主要含有CO 气体,写出CO 燃烧的化学方程式 _______ ;煤气与天然气相比,从安全角度看,煤气的主要缺点是 _________;从环境保护的角度考虑,在煤气、天然气和氢气中,首选的燃料是 __________。
【答案】 游离态 同素异形体 石墨 金刚石 光合 温室效应 CaCO3![]() CaO+CO2↑ 化学 金属 CO2+H2O
CaO+CO2↑ 化学 金属 CO2+H2O![]() H2CO3 增大 增大压强、降低温度都会增大气体的溶解度 2CO+O2=2CO2 煤气中含有的CO有毒 H2
H2CO3 增大 增大压强、降低温度都会增大气体的溶解度 2CO+O2=2CO2 煤气中含有的CO有毒 H2
【解析】①元素以单质的形式存在,属于游离态;由同种元素组成的不同种单质互为同素异形体;石墨具有导电性,用于电极;金刚石硬度大,用于切割大理石;②二氧化碳是植物光合作用的原料;二氧化碳增多会造成温室效应;a.工业上高温煅烧石灰石产生二氧化碳的化学方程式:CaCO3![]() CaO+CO2↑;b.二氧化碳转化为具有多种用途的一氧化碳或甲醇,生成新物质,属于化学变化;镍和钯都属于金属;c.二氧化碳和水生成碳酸,反应的化学方程式:CO2+H2O=H2CO3;二氧化碳在冰冷的深海中溶解度比在通常状况下水中的溶解度会增大,原因是增大压强、降低温度都会增大气体的溶解度;③CO 燃烧的化学方程式为:2CO+O2
CaO+CO2↑;b.二氧化碳转化为具有多种用途的一氧化碳或甲醇,生成新物质,属于化学变化;镍和钯都属于金属;c.二氧化碳和水生成碳酸,反应的化学方程式:CO2+H2O=H2CO3;二氧化碳在冰冷的深海中溶解度比在通常状况下水中的溶解度会增大,原因是增大压强、降低温度都会增大气体的溶解度;③CO 燃烧的化学方程式为:2CO+O2![]() 2CO2;煤气中含有一氧化碳,会引起中毒;氢气燃烧后生成水,是最理想的燃料。
2CO2;煤气中含有一氧化碳,会引起中毒;氢气燃烧后生成水,是最理想的燃料。

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】阅读下面科普短文。
在中国古代化工发展的历史征程中,我国古代先民们在火药、制陶烧瓷、炼铜冶铁等化学加工技术方面取得了许多非凡的成就,为促进我国古代社会发展和人类的进步做出了重大的贡献。
【火药】人类最早使用的火药是黑火药,主要反应如下:

【制陶烧瓷】瓷器与陶器,都属于硅酸盐系列制品,最主要的化学成分是二氧化硅(SiO2)、氧化铝(Al2O3)及多种金属(Ca、Mg、Fe、K、Na等)氧化物。但在化学成分含量、用途等方面却大有区别。
制品 | 化学成分 | 性能用途等 |
陶器 | Al2O3 约15%~18%; Fe2O3约5%~6%; CaO、MgO等≥3%。 | 粗糙,不够坚硬,常用于取水、盛放食物等。 |
瓷器 | Al2O3 约18%~28%; Fe2O3约1%~2%; CaO、MgO等≤1%。 | 高温烧结,坚硬致密,洁白,薄, 呈半透明,敲击时清脆悦耳,美观,用途广泛,观赏、收藏价值高等。 |
【金属冶炼】制陶发展起来的高温技术为金属的冶炼、熔铸创造了条件,我国由新石器时代晚期逐步进入了先是炼铜(称为“青铜器时代”)后是炼铁(称为“铁器时代”)的金属时代。
青铜冶炼
天然铜夹杂在铜矿石之中,人们在加热熔化天然铜的过程中,将绿色的孔雀石[Cu2(OH)2CO3]、棕或黑色的锡石(SnO2)、蓝色的方铅矿(PbS)放在一起烧,便产生了青铜。青铜是铜与锡或铅熔成的合金。熔点比纯铜(1083℃)低100℃~300℃,更易加工和铸造,铸造性能也比纯铜好,硬度几乎提高一倍,适合制作工具和兵器。
铁的冶炼
到了春秋中后期,我国先民们在熟悉地掌握了块炼法炼铁后,又在世界上率先发明了以高温液体还原法冶炼生铁的技术,这在冶金史上是一个划时代的进步。
随着炼铁技术的进步,人们也逐渐懂得了炼钢。生铁和钢都是铁碳合金。含碳量>2%,为生铁;含碳量<0.02%,为纯铁;含碳量在两者之间为钢。依据文章内容回答下列问题。
(1)黑火药的主要成分是________。
(2)陶器与瓷器化学成分的主要区别是_________。
(3)生铁的碳含量______(填“高于”或“低于”)钢的碳含量。
(4)与纯金属相比,合金的优点可能是________。
【答案】 硝酸钾、木炭、硫(KNO3 、C、S) 陶瓷中Al2O3含量比瓷器低,Fe2O3、CaO、MgO含量比瓷器高 高于 硬度大、熔点低
【解析】本题考查了根据短文黑火药、陶器与瓷器化学成分,铁合金的成分和性质,认真阅读短文是解题的关键。
(1)从题中提供的化学方程式可知,黑火药的主要成分是硝酸钾、木炭、硫(KNO3 、C、S);
(2)根据陶器与瓷器化学成分表可知,陶器与瓷器化学成分的主要区别是:陶瓷中Al2O3含量比瓷器低,Fe2O3、CaO、MgO含量比瓷器高;
(3)生铁和钢都是铁碳合金。含碳量>2%,为生铁;含碳量<0.02%,为纯铁;含碳量在两者之间为钢。生铁的碳含量高于钢的碳含量;
(4)与纯金属相比,合金的优点可能是:硬度大、熔点低。
【题型】简答题
【结束】
21
【题目】工业上制取硝酸铵(NH4NO3)的流程图如下,请回答下列问题。
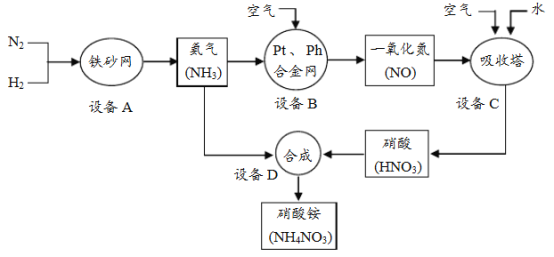
(1)设备A中,发生的反应属于基本反应类型中的________。
(2)设备B、C中,空气中的______一定参加了反应。
(3)设备C中,生产硝酸过程排出的废气中会含有一些氮的氧化物,可用如下两种
方法处理:
方法一、NaOH溶液吸收法:NO + NO2 + 2NaOH = 2NaNO2 + H2O
方法二、NH3还原法:8NH3 + 6NO2![]() 7N2 + 12H2O(NO也有类似的反应)
7N2 + 12H2O(NO也有类似的反应)
以上两种方法中,你认为哪种方法好并说明理由________。
(4)设备D中,用NH3和HNO3制备NH4NO3。NH4NO3中氮元素质量分数的计算式为________。
【题目】20℃时,NaCl溶解于水的实验数据如表。则下列叙述正确的是
实验序号 | 水的质量(g) | 加入NaCl的质量(g) | 溶液的质量(g) |
① | 10 | 2 | 12 |
② | 10 | 3 | 13 |
③ | 10 | 4 | 13.6 |
④ | 10 | 5 | 13.6 |
A. 20℃时10g水最多能溶解4g NaCl
B. ①所得溶液的溶质质量百分数为20%
C. ②中所得溶液是饱和溶液
D. ③④溶液的溶质质量分数相等