题目内容
【题目】金属锌与稀硫酸反应生成硫酸锌和氢气,化学课外小组的同学对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;b.可能与锌的形状有关。
【设计并实验】小组同学用不同质量分数的硫酸和不同形状的锌进行如下实验。

实验编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
20% | 锌粒 | 31.7 | |
20% | 锌片 | 50.9 | |
30% | 锌粒 | 61.7 | |
30% | 锌片 | 79.9 |
(1)小组同学用右图装置收集并测量氢气的体积,其中量筒的作用是 ,氢气应从 (填e或f或g)管通入。(已知:氢气难溶于水)
【收集证据】
(2)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是 。
【得出结论】
(3)结论是 。
【评价与反思】
(4)下表是小组同学第①组实验的详细数据。
时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
请描述锌与硫酸反应快慢的变化 ,并解释第二分钟以后变化的原因 。
(5)锌与硫酸反应的快慢可能还受温度因素的影响,请设计实验验证 。
【答案】(1) 根据进入量筒中水的体积,判断生成氢气的体积 e
(2) ①③或②④
(3) 硫酸的质量分数越大,反应速率越快或锌与硫酸的接触面积越大,反应速率越快
(4)由慢到快然后逐渐减慢 因为随着反应的进行,硫酸被消耗,硫酸溶质质量分数变小
(5)取质量形状相等的锌粒分别放入两只试管中,然后分别加入温度不同,体积和溶质质量分数相同的稀硫酸,测量收集等体积的氢气所需要的时间
【解析】
试题
(1)比较锌与硫酸反应的快慢主要通过比较产生氢气的体积来比较,那么可根据进入量筒中水的体积,判断生成氢气的体积;
(2)要比较不同质量分数的硫酸对反应快慢的影响应采用控制变量法,即只有一个变量,气体是因素要完全相同;
通过①③或②④的比较可知:硫酸的质量分数越大,反应速率越快或锌与硫酸的接触面积越大,反应速率越快;
通过表格可发现锌与硫酸反应由慢到快然后逐渐减慢,第二分钟以后由于随着反应的进行,硫酸被消耗,硫酸溶质质量分数变小,故反应速率变慢。

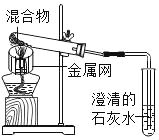
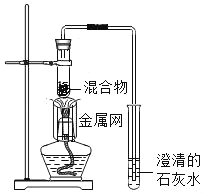
【题目】为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
(查阅资料)①氧化铜(CuO)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4═CuSO4+H2O+Cu。
(进行实验)
实验1:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
序号 | 1﹣1 | 1﹣2 |
装置 |
|
|
反应后物质的颜色、状态 | 黑色粉末中混有少量红色固体 | 红色固体有金属光泽,混有极少量黑色物质 |
实验2:取一定量的混合物,用1﹣2装置进行实验。
序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
2﹣1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2﹣2 | 1:10 | 混有很少量黑色物质 | |
2﹣3 | 1:11 | 混有极少量黑色物质 | |
2﹣4 | 1:12 | 无黑色物质 | |
2﹣5 | 1:13 | 混有较多黑色物质 | |
(解释与结论)
(1)配平化学方程式:C+_____CuO![]() _____Cu+_____CO2↑。
_____Cu+_____CO2↑。
(2)实验1﹣2中,证明产生了CO2的现象是_____。
(3)实验1的目的是_____。
(4)实验2的结论是_____。
(反思与评价)
(5)实验2没有进行质量比为1:14的实验,理由是_____。
(6)为检验2﹣4的红色固体中是否含Cu2O,所需试剂是_____。