题目内容
【题目】实验探究能够从实际的实验来总结和探究一般规律。请完成下列两个实验探究。
(探究一)空气中氧气含量的再测定
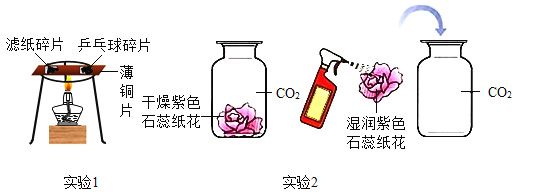
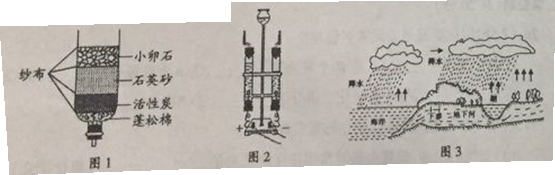
如图所示是某同学测定空气中氧气含量的装置。玻璃管中装的是细铜丝。(已知:铜+氧气氧化铜;氧化铜常温下是固体)
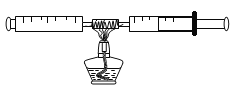
(1)若加热前,两注射器组成的密闭系统中有30mL空气,停止加热冷却到室温后,理论上密闭容器中剩余的气体的体积为________mL,由此证明空气中氧气约占空气总体积的_________。
(2)不同的同学在做上述实验时结果差别较大,甲同学最后剩余气体26mL,你认为可能的原因是______、_____。
(3)该实验不能将铜丝换成木炭的原因是________。
(探究二)实验室制取二氧化碳药品的选择
某硏究小组在实验室制取二氧化碳的硏究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,反应速率逐渐减慢甚至停止。该小组猜测,是否硫酸的浓度会对实验效果造成影响?他们试图选择出合适浓度的硫酸。
(实验)选择合适浓度的硫酸
操作:在28℃时,分别向五支各盛有等量大理石的试管中加入等体积硫酸,15分钟内生成气体的体积见下表:
试管编号 | 1 | 2 | 3 | 4 | 5 |
硫酸浓度(%) | 15 | 20 | 25 | 30 | 35 |
气体体积(mL) | 35 | 47 | 55 | 51 | 42 |
请回答:
(1)稀硫酸与大理石反应,在28℃时,选用硫酸的浓度最合适为_________%。
(2)除选用合适浓度的硫酸之外,在反应过程中,为防止硫酸钙覆盖在大理石上,应增加__________操作,更有利于气体的制备。
(3)大理石和稀硫酸反应生成硫酸钙(CaSO4)、水和二氧化碳,试写出反应的化学表达式_____。
(4)提出猜想:请写出另一种你认为可能影响反应速率的因素____。
【答案】24 1/5 铜丝量不足 加热过程中没有来回拉动活塞,氧气没有充分反应 木炭燃烧产生的二氧化碳是气体,不会形成压强差 25% 粉碎固体、玻璃棒搅拌、振荡试管(一点即可) ![]() 反应温度、固体颗粒的大小、是否有催化剂
反应温度、固体颗粒的大小、是否有催化剂
【解析】
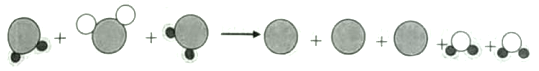
铜和氧气加热生成氧化铜,木炭在氧气中点燃生成二氧化碳,大理石和稀硫酸反应生成硫酸钙(CaSO4)、水和二氧化碳。
(1)氧气约占空气总体积的五分之一,若加热前,两注射器组成的密闭系统中有30mL空气,停止加热冷却到室温后,理论上密闭容器中剩余的气体的体积为![]() ,由此证明空气中氧气约占空气总体积的
,由此证明空气中氧气约占空气总体积的![]() 。
。
(2)反应后剩余气体较多,说明反应物量不足,或气体没有消耗尽,甲同学最后剩余气体26mL,可能的原因是铜丝量不足、加热过程中没有来回拉动活塞,氧气没有充分反应。
(3)木炭在氧气中点燃生成二氧化碳,补充了消耗的氧气的体积,不能形成压强差,故该实验不能将铜丝换成木炭的原因是的二氧化碳是气体,不会形成压强差。
[探究二]
(1)稀硫酸与大理石反应,在28℃时,硫酸浓度为25%时生成的气体的体积最大,故选用硫酸的浓度最合适为25%。
(2)反应物充分反应的条件是增大反应物的接触面积,增大反应物的浓度,除选用合适浓度的硫酸之外,在反应过程中,为防止硫酸钙覆盖在大理石上,应增加粉碎固体、玻璃棒搅拌、振荡试管操作,更有利于气体的制备。
(3)大理石和稀硫酸反应生成硫酸钙(CaSO4)、水和二氧化碳,反应的化学表达式为![]() 。
。
(4)提出猜想:影响反应速率的因素是反应温度、固体颗粒的大小、是否有催化剂。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】不同实验对反应速率有不同要求。某兴趣小组探究CO2制取实验,请按要求回答下列问题。
控制反应速率的方法有:①反应物的浓度 ②反应物的状态
限选试剂:A稀盐酸 B.浓盐酸 C块状石灰石 D碳酸钠溶液 E粉末状石灰石
(1)请在表中短线上填上所选试剂对应的序号。
实验名称 | 控制速率的方法 | 所选用的最佳试剂 |
灭火器反应原理 | ① | ____和D |
CO2的实验室制法 | ② | A和_____ |
(2)根据上表写出灭火器反应原理的化学方程式____________________
(3)已知:CO2和SO2既有相似性,又有差异性。
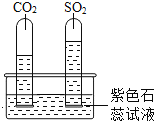
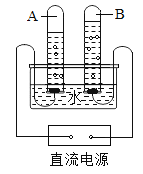
实验一:水槽中滴入紫色石蕊,将收集满两种气体的试管同时倒立于其中,片刻后实验现象如图所示,说明相同条件下的溶解性:SO2________(填“>”或“<”)CO2,试管内溶液变成________色。
实验二:已知镁条可以在CO2中剧烈燃烧生成氧化镁和碳,写出该反应的化学方程式____________。