题目内容
【题目】实验室有一瓶长期露置于空气中氢氧化钠溶液,确认已变质。某学习小组展开如下探究,确定该溶液的成分,并进一步制定回收方案。
【问题1】久置的氢氧化钠溶液是全部变质?还是部分变质?
【探究1】确定该溶液中溶质的成分。
【资料1】BaCl2溶液、Ba(NO3)2溶液、CaCl2溶液、Ca(NO3)2溶液、NaNO3溶液均显中性。
实验操作 | 实验现象 | 实验结论 |
Ⅰ.取少量溶液于试管中,向溶液中滴加 (14) 溶液,并不断振荡。 | 白色沉淀产生 | 该溶液部分变质,含有 碳酸钠和氢氧化钠。 |
Ⅱ.将步骤Ⅰ反应后的混合物静置,取少量上层清液,滴加2~3滴酚酞试液。 | (15) |
氢氧化钠溶液变质的原因 (16) (用化学方程式表示),因此氢氧化钠溶液必须密封保存。
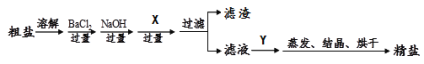
【问题2】如何从变质的氢氧化钠溶液中回收得到较纯净的氢氧化钠固体。
【探究2】回收纯净的氢氧化钠固体。
【资料2】在不同温度下NaOH的溶解度如下:
温度(℃) | 10 | 20 | 40 | 60 | 80 | 100 |
溶解度(g/100g水) | 64 | 85 | 138 | 203 | 285 | 376 |
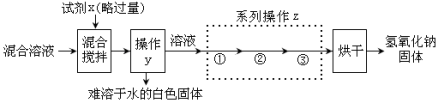
请回答下列问题:
Ⅰ.试剂x的化学式 (17) ,操作y的名称为 (18) 。
Ⅱ.根据相关物质的溶解度数据,系列操作z中 ② 操作名称为 (19) 。
Ⅲ.探究1中的物质检验和探究2中的除杂提纯都将碳酸钠进行了转化,但二者目的不同,分别是 (20) 、 (21) 。
【答案】(14)过量(或足量或适量)的氯化钙溶液(15)溶液变红色
(16)CO2 +2NaOH→Na2CO3 +H2O (17)Ca(OH)2(18)过滤
(19)降温结晶或冷却结晶(冷却热饱和溶液),仅表述为“结晶”不得分
(20)实验探究1中将碳酸钠转化为氯化钠目的是排除对氢氧化钠检验的干扰;
(21)实验探究2除杂是为了除去产品中的杂质而将碳酸钠转化为产品氢氧化钠。
【解析】
试题分析:(14)碳酸钠和氢氧化钠溶液都呈碱性,验证时先加入足量的氯化钙溶液验证并除掉碳酸钠,排除多氢氧化钠验证的干扰(15)部分变质时,有氢氧化钠,溶液显碱性,溶液变红色
(16)氢氧化钠和空气中的二氧化碳反应变质:CO2 +2NaOH→Na2CO3 +H2O
(17)Ca(OH)2和碳酸钠反应生成氢氧化钠和碳酸钙沉淀,能除掉碳酸钠,又不引入新的杂质。
(18)将固体和液体分离的操作是过滤
(19)降温结晶或冷却结晶(冷却热饱和溶液),仅表述为“结晶”不得分
(20)实验探究1中将碳酸钠转化为氯化钠目的是排除对氢氧化钠检验的干扰;
(21)实验探究2除杂是为了除去产品中的杂质而将碳酸钠转化为产品氢氧化钠。

【题目】有一种石灰石样品,其中含有的杂质是二氧化硅(它是一种不溶于水,也不与盐酸反应,耐高温的固体物质),某同学想测定该样品的纯度,他取用2 g这种石灰石样品,把20 g稀盐酸分四次加入,充分反应后剩余固体的质量如下表所示:
稀盐酸的质量 | 剩余固体的质量 |
第一次加入5 g | 1.315 g |
第二次加入5 g | 0.63 g |
第三次加入5 g | 0.3 g |
第四次加入5 g | 0.3 g |
(1)2 g石灰石样品中的杂质质量是 g;
(2)石灰石样品的纯度为 ;
(3)100 kg这种纯度的石灰石充分煅烧后,可得到固体多少千克?