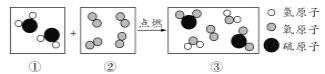
题目内容
【题目】为测定某放口放置的氢氧化钠溶液的变质情况,某同学实验并记录如图:
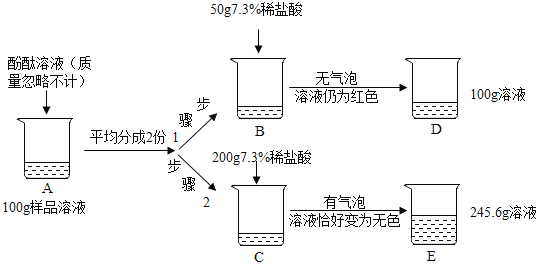
(1)配置如图实验步骤1所用的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是______;
(2)B烧杯中发生反应的化学方程式为_______;
(3)根据已知条件求解A烧杯溶液中碳酸钠质量分数_______(写出解题过程);
(4)D烧杯溶液中溶质的化学式为_______;(不考虑酚酚酞)
【答案】10g NaOH+HCl═NaCl+H2O 21.2% NaCl、Na2CO3、NaOH
【解析】
(1)需要质量分数为36.5%的浓盐酸的质量是:![]() =10g;
=10g;
(2)B烧杯中加入盐酸后无气泡产生,溶液仍然是红色,所以发生的反应是氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为:NaOH+HCl=NaCl+H2O;
(3)生成二氧化碳的质量为50g+200g-245.6g=4.4g,
设C烧杯溶液中碳酸钠质量为x,消耗氯化氢的质量为y
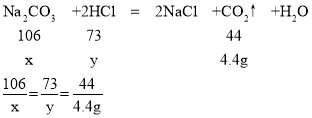
x=10.6g
y=7.3g
样品溶液中碳酸钠质量是10.6g×2=21.2g;
A烧杯溶液中碳酸钠质量分数为![]() =21.2%。
=21.2%。
答:A烧杯溶液中碳酸钠质量分数为21.2%。
(4)与碳酸钠反应的稀盐酸的质量为![]() =100g,与氢氧化钠反应的稀盐酸的质量为:200g-100g=100g,所以步骤1中加入的50g稀盐酸没有反应完氢氧化钠,所以D烧杯溶液中溶质的化学式为NaCl、NaOH、Na2CO3;
=100g,与氢氧化钠反应的稀盐酸的质量为:200g-100g=100g,所以步骤1中加入的50g稀盐酸没有反应完氢氧化钠,所以D烧杯溶液中溶质的化学式为NaCl、NaOH、Na2CO3;
故答案为:(1)10g;
(2)NaOH+HCl═NaCl+H2O;
(3)21.2%;
(4)NaCl、Na2CO3、NaOH。

 名校课堂系列答案
名校课堂系列答案【题目】在一密闭容器内有氧气、二氧化碳、水蒸气及一种未知物质M,在一定条件下充分反应。测得反应前后各物质的质量如下表:
物质 | 氧气 | 二氧化碳 | 水蒸气 | M |
反应前的质量/g | 68 | 1 | 1 | 16 |
反应后的质量/g | 4 | 45 | 37 | x |
下列说法错误的是( )
A.x的值为0
B.未知物质M中一定含有的元素为C、H、O
C.若未知物质M的相对分子质量为16,则其化学式为![]()
D.该反应符合质量守恒定律