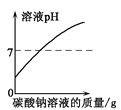
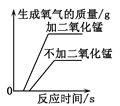
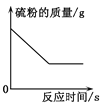
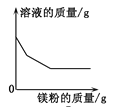
题目内容
【题目】在一密闭容器内有氧气、二氧化碳、水蒸气及一种未知物质M,在一定条件下充分反应。测得反应前后各物质的质量如下表:
物质 | 氧气 | 二氧化碳 | 水蒸气 | M |
反应前的质量/g | 68 | 1 | 1 | 16 |
反应后的质量/g | 4 | 45 | 37 | x |
下列说法错误的是( )
A.x的值为0
B.未知物质M中一定含有的元素为C、H、O
C.若未知物质M的相对分子质量为16,则其化学式为![]()
D.该反应符合质量守恒定律
【答案】B
【解析】
氧气反应后少了64g说明反应了64g,二氧化碳多了44g说明生成了44g二氧化碳,水蒸气多了36g说明生成了36g水,根据质量守恒定律,M属于反应物,并且反应了16g,所以X值为0;根据质量守恒定律,M属于反应物,并且反应了16g,所以X值为0,算出二氧化碳中碳元素的质量为12g,水中氢元素的质量为4g,又因为二氧化碳中碳元素的质量、水中氢元素的质量都是由M中出来的,而12g+4g=16g所以M中无氧元素。
A、X值为0,说法正确,不符合题意;
B、M中无氧元素,说法错误,符合题意;
C、M中C、H原子个数比为:![]() ,物质M的相对分子质量为16,化学式为:
,物质M的相对分子质量为16,化学式为:![]() ,说法正确,不符合题意;
,说法正确,不符合题意;
D、该反应符合质量守恒定律,说法正确,不符合题意;
故选:B。

【题目】过氧化钠(化学式为Na2O2)可用在呼吸面具中作为氧气来源。Na2O2能和CO2反应生成O2和另一种固体化合物(用X表示)。
(提出猜想)有同学猜想X可能是酸、碱或盐中的一种。通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是_____。
(设计方案)请完成下表。
实验步骤 | 实验现象 | 实验结论 |
实验一:取少量X,滴加稀盐酸,将产生的气体通入澄清石灰水。 | 有气泡产生;_____ | X为Na2CO3 |
实验二:取少量X,加水配成溶液,滴加碱的溶液,该碱可能是_____。 | 生成白色沉淀 |
(拓展探究)用下图所示装置进行二氧化碳与过氧化钠(Na2O2)的反应。
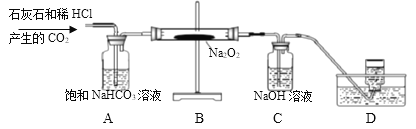
(1)装置A的作用是吸收CO2中混有的HCl,装置C中反应的化学方程是_____。
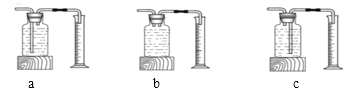
(2)测量装置D中收集的气体体积,可用下图中的_____进行收集。
(3)兴趣小组查阅资料发现Na2O2也能跟H2O反应生成NaOH和O2。为探究反应后装置B中固体的成分,甲同学取固体于试管中,加足量水,无气泡产生,则固体中一定没有_____。将所得溶液分成两份,进行下表所示实验:
实验操作 | 实验现象 | 分析与结论 |
向一份溶液中滴加过量的稀HCl | 有气泡产生 | B中固体有Na2CO3 |
向另一份溶液中_____ | 溶液变红 | B中固体有NaOH |
(定量计算)取充分反应后B中Na2CO3和NaOH混合物,投入200g7.3%的稀盐酸中恰好完全反应,称得反应后溶液的质量为234g,计算反应后所得溶液中溶质的质量分数。_____
(交流反思)若在装置A、B之间连接一个盛有_____的洗气瓶,完全反应后,装置B中的固体只有Na2CO3。