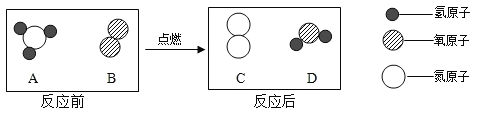
题目内容
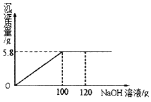
【题目】某NaCl样品中混有杂质MgCl2,为了测定样品中MgCl2的质量分数。取固体样品50.0g完全溶解于水中,并向其中逐渐加入NaOH溶液,实验过程中生成沉淀的质量与加入NaOH溶液的质量的关系如下图所示:
注:发生反应的化学方程式为MgCl2+2NaOH==Mg(OH)2↓+2NaCl
请根据相关信息完成下列计算:
(1)反应完全时生成氢氧化镁的质量_______g。
(2)样品中氯化镁的质量分数。_____。
【答案】5.8 19%
【解析】
(1)反应过程中只生成氢氧化镁沉淀,则由生成沉淀的质量与加入NaOH溶液的质量的关系图可知,反应完全时生成氢氧化镁的质量为5.8g。
(2)生成的总沉淀的质量计算出氯化镁的质量,用氯化镁的质量除以原固体混合物的质量,乘以百分之百即可。
设原固体混合物中MgCl2的质量为x

![]()
x=9.5g
样品中氯化镁的质量分数为![]()
则样品中氯化镁的质量分数为19%。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】一些金属易生锈,某小组同学设计如下实验,对金属锈蚀进行探究.
【实验一】取5枚去油去锈的洁净铁钉,分别装入下表的试管中,进行实验.
实验图示 |
|
|
|
|
|
生锈时间 | 8min | 较长时间不生锈 | 5min | 3min | 1min |
(1)通过上述实验可知,温度越高铁钉生锈速率越____(填“慢”或“快”);在_____(填“酸性”、“碱性”或“中性”)环境中铁钉生锈速率较快.
【实验二】为探究铁锈的成分,用图1所示装置(夹持仪器已省略)进行实验(每步反应和吸收均完全).
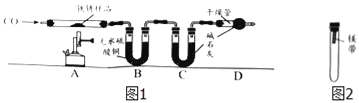
【查阅资料】无水硫酸铜能吸收水而变蓝,碱石灰既能吸收水也能吸收CO2.
(2)请指出图1所示实验装置的一个明显缺陷:___________________.
(3)加热前,先通入CO一段时间,目的是____________________.
(4)将铁锈样品加热,样品逐渐变黑,无水硫酸铜逐渐变蓝,由此推知铁锈中一定含有_____元素,从而推断出空气中的_______参加了铁生锈反应.
【实验记录】
铁锈样品的质量/g | 装置B的质量/g | 装置C的质量/g | |
反应前 | 23.2 | 232.4 | 198.2 |
反应后 | / | 239.6 | 211.4 |
(5)根据上表数据推算,可确定铁锈的成分,用FexOynH2O表示,则n=_______;若缺少D装置,x:y的值_________(填“偏大”、“偏小”或“无影响”).
(6)欲通过实验探究镁带在空气中锈蚀的条件,用图2所示装置,试管内可选用的物质如下:
①O2 ②水 ③CO2 ④O2和CO2 ⑤CO2和水 ⑥O2和水 ⑦O2、CO2和水
至少需要选用___________(填数字序号),才能达到探究镁带锈蚀的条件.
(7)请写出镁带在空气中锈蚀,生成碱式碳酸镁[Mg3(OH)2(CO3)2]的化学方程式_______.