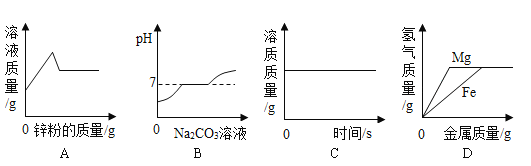
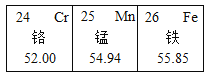
题目内容
【题目】黄铜是由铜和锌组成的合金,可用于制造钱币、机器零件等。利用黄铜制造各种物品的过程中,会产生大量的黄铜渣,主要含有Zn、Cu、ZnO、CuO。一种利用黄铜渣获取金属铜和硫酸锌溶液的实验流程如下:
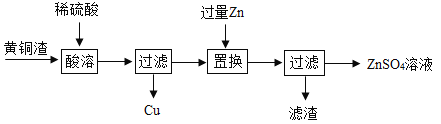
(1)下列关于黄铜的说法正确的是_____。
a 黄铜不能被腐蚀
b 黄铜的硬度比铜大
c 黄铜的熔点比锌高
(2)“酸溶”过程中有气体生成,写出生成该气体的化学方程式:_______。
(3)“置换”过程中需要加入过量Zn的目的是_________。
(4)为进一步提高原料利用率,得到更多的铜和硫酸锌溶液,需要对流程中的“滤渣”进行处理,向滤渣中缓慢加入___(选填“稀硫酸”或“稀盐酸”)并不断搅拌,观察到____时停止加入,过滤。
(5)上述流程中,能判断锌的金属活动性比铜强的事实是______(任写一条)。
【答案】b Zn+H2SO4=ZnSO4+H2↑ 使硫酸铜全部反应 稀硫酸, 无气泡冒出(无气体产生) “酸溶”过程中Zn能与稀H2SO4反应,而Cu不能反应(或“置换”过程中锌能置换出硫酸铜溶液中的铜)
【解析】
(1)
a、黄铜是铜、锌混合物,能被酸腐蚀,故错误;
b、合金的硬度一般比组成它的纯金属大,则黄铜的硬度比铜大,故正确;
c、合金的熔点一般比组成它的纯金属低,则黄铜的熔点比锌低,故错误。
故选b
(2)“酸溶”过程是锌和稀硫酸反应生成硫酸锌和氢气,其化学方程式Zn+H2SO4=ZnSO4+H2↑。
(3)“置换”过程中需要加入过量Zn的目的是使硫酸铜全部反应,过滤得到纯净的硫酸锌溶液。
(4)向滤渣中缓慢加入稀硫酸并不断搅拌,观察到无气泡冒出时停止加入,过滤得到硫酸锌溶液。
(5)能判断锌的金属活动性比铜强的事实是“酸溶”过程中Zn能与稀H2SO4反应,而Cu不能反应。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】为了测定某银、锌合金(假设合金中只含银和锌)中银的质量分数,某同学称取20g银锌合金粉末进行实验,现将125g稀硫酸分五次加入合金粉末中,充分反应后测得生成气体的总质量如表所示:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
滴入稀硫酸的质量/g | 25 | 25 | 25 | 25 | 25 |
生成气体的总质量/g | 0.05 | m | 0.15 | 0.20 | 0.20 |
请完成下列问题:
(1)表中m的值为 ;
(2)银、锌合金中银的质量分数为 ;
(3)所用稀硫酸的溶质质量分数是多少?(写出具体计算过程)
【题目】小明利用下列装置对物质燃烧进行四个实验的探究,实验探究过程和观察记录如下:
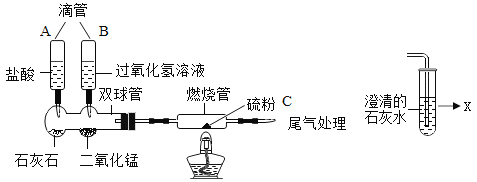
(1)实验操作及记录
实验 | 操作 | 现象 |
实验一 | 仪器X的名称为_______;根据装置图组装仪器,不点燃酒精灯 | 硫不燃烧 |
实验二 | 点燃酒精灯 | 硫燃烧,发出微弱淡蓝色的火焰 |
实验三 | 更换燃烧管(装有等量硫粉),挤压滴瓶A,该处发生反应的化学方程式是________。使气体通过燃烧管,将装置内空气完全排出后,点燃酒精灯 | 硫不燃烧 |
实验四 | 更换燃烧管(装有等量硫粉),挤压滴瓶B,该处发生反应的化学方程式是_______。使气体通过燃烧管一段时间,为了确定燃烧管中充满氧气,可在尾气出口处采用的操作是____。点燃酒精灯 | 硫燃烧,发出明亮蓝紫色的火焰 |
(2)实验分析及结论
对照实验一和实验二的现象,小明同学认为硫燃烧发生的条件是______________。