题目内容
(8分)“海水晒盐”所获得的粗盐中,除含有泥沙等难溶性杂质外,还含有氯化镁、氯化钙等可溶性杂质,某化学小组为得到较纯净的食盐,进行了下列实验探究活动,请参与他们的探究活动。
[提出问题]如何获得较纯的食盐晶体?
[查阅资料]
20℃时,部分物质的溶解性
情况如下表所示:
| OH- | CO32- |
Na+ | 溶 | 溶 |
Ca2+ | 微 | 不 |
Mg2+ | 不 | 微 |
[实验方案]按如下方案进行提纯粗盐。
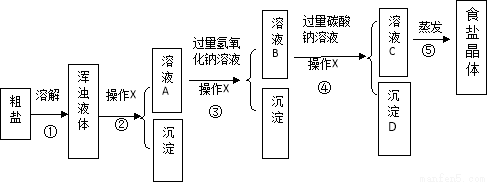
[解释与结论]
(1)实验操作X的名称是 ;沉淀D是 。
(2)为达到除去难溶性杂质的实验步骤是 。(填序号)
(3)实验步骤③的主要目的是 (用化学方程式回答);判断氢氧化钠溶液已过量的方法是 。
(4)在进行实验步骤⑤的蒸发时,为防止液体飞溅和获得相对更纯的食盐晶体需要进行的操作是 。
[反思与评价]
(5)有同学认为该实验方案并不完善,其理由及需补充的实验操作是 。
(1)过滤;碳酸钙
(2)①②
(3)MgCl2+2NaOH=Mg(OH)2↓+2NaCl;取溶液B少量于试管中,滴加1—2滴酚酞试液,溶液变红色
(4)用玻璃棒不断搅拌蒸发皿中的液体,当出现少量固体时,停止加热。
(5)在除去MgCl2和CaCl2的同时,又引入了新的杂质NaOH和Na2CO3。向溶液C中逐滴加入稀盐酸至不再产生气泡为止。
【解析】
试题分析:(1)实验中操作X的作用是将浑浊的液体分离成溶液和沉淀,所以操作的名称是过滤。步骤④是通过加入的碳酸钠和粗盐中的氯化钙反应,生成碳酸钙沉淀;达到除去氯化钙的目的。所以沉淀D为碳酸钙。
(2)通过①溶解、②过滤可以把粗盐中不溶性杂质除去。
(3)氢氧化钠可与氯化镁反应生成氢氧化镁沉淀,从而达到除去氯化镁的目的。反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;氢氧化钠溶液呈碱性,可通过“取溶液B少量于试管中,滴加1—2滴酚酞试液,溶液变红色”来判断氢氧化钠溶液已过量
(4)蒸发过程中必须用玻璃棒不断搅拌,当加热至较多固体出现时,应停止加热利用余热蒸干.以防止局部温度过高而使液体飞溅.
(5)做出这种评价的依据是:在除去MgCl2和CaCl2的同时,又引入了新的杂质NaOH和Na2CO3。所以可向溶液C中加入盐酸除去过量的NaOH和Na2CO3。当加入盐酸不再产生气泡时,溶液恰好完全反应。
考点:粗盐的提纯、复分解反应

 阅读快车系列答案
阅读快车系列答案某校化学小组同学从家中带来淀粉、食盐、纯碱、泡打粉、去污粉和部分变质的熟石灰6种固体物质。老师从中取出任意3种并编号,让小组同学通过实验确认分别为哪种固体。

【查阅资料】
1.该去污粉主要成分为碳酸钠和碳酸钙
2.该泡打粉的主要成分是碳酸氢钠和有机酸
3.熟石灰变质的原因是 (用化学方程式表示)。
【实验准备】
为顺利完成任务,小组同学在老师指导下进行了如下预备实验。部分现象记录如下:
| 实验1 取样,加足量水充分溶解 | 实验2 取样,加入适量稀盐酸 |
淀粉 | 白色浑浊,试管底部有不溶物 | 无明显现象 |
泡打粉 | 有气体产生,试管底部有白色不溶物 | 有气体产生 |
【实验过程】
小组同学对老师提供的三种固体进行实验探究。部分现象记录如下:
| 实验1 取样,加足量水充分溶解 | 实验2 取样,加入适量稀盐酸 | 实验3 取实验1上层清液,加入3滴酚酞溶液 |
固体Ⅰ | 有气体产生,试管底部有白色不溶物 | 有气体产生 |
|
固体Ⅱ | 固体溶解,形成无色溶液 | 有气体产生 | 溶液变红 |
固体Ⅲ | 有白色浑浊,试管底部有白色不溶物 | 有气体产生 | 溶液变红 |
【得出结论】
1.固体Ⅱ、Ⅲ加水形成的溶液pH 7 (填“>”、“<”或“=”);
2.分析以上实验现象得知,固体Ⅰ是 ,固体Ⅱ是 。
3.小组同学通过讨论认为固体Ⅲ不能确定。请你设计确认该固体的实验方案 。
【实验反思】
检验和鉴别也是实际生活中经常遇到的问题。面对多种物质的检验和鉴别,上述实验活动给我们的启示是 。






