题目内容
(6分)化学兴趣小组的同学用如下图所示装置做中和反应实验,请按要求回答问题。

(1)向盛有氢氧化钠溶液的烧杯中滴入酚酞溶液,溶液变为红色,此时溶液的pH 7(填“>”或“<”或“=”),用胶头滴管吸取盐酸逐滴加入烧杯中,并不断用玻璃棒搅拌,当溶液刚好由红色变成 色时,恰好完全中和,停止加入盐酸,该反应的化学方程式为 。
(2)实验(1)中,某同学又多加了几滴盐酸,这时溶液显 性,此时溶液中的溶质为 。
(1)> 无 NaOH+HCl=NaCl+H2O
(2)酸 ; HCl、NaCl、酚酞
【解析】
试题分析:(1)氢氧化钠溶液的pH>7呈碱性,可使酚酞溶液变为红色。用胶头滴管吸取盐酸逐滴加入烧杯中,盐酸会与氢氧化钠反应生成氯化钠和水。反应的化学方程式为NaOH+HCl=NaCl+H2O 当二者恰好完全反应时,溶液的pH=7,呈中性,溶液显无色。
(2)这时再加入盐酸,溶液中盐酸有剩余,显酸性,此时溶液中的溶质为原来存在的酚酞、反应生成的氯化钠和过量的盐酸。
考点:中和和反应

如图所示,在小烧杯中盛有饱和石灰水,大烧杯中盛有试剂X。将试剂Y加入到大烧杯中,观察到的小烧杯中的现象正确的是

序号 | 试剂X | 试剂Y | 小烧杯中的现象 |
A | 水 | 硝酸铵 | 产生白色沉淀 |
B | 水 | 浓硫酸 | 无明显变化 |
C | 盐酸 | 碳酸钠 | 无明显变化 |
D | 稀硫酸 | 镁条 | 产生白色沉淀 |
(8分)“海水晒盐”所获得的粗盐中,除含有泥沙等难溶性杂质外,还含有氯化镁、氯化钙等可溶性杂质,某化学小组为得到较纯净的食盐,进行了下列实验探究活动,请参与他们的探究活动。
[提出问题]如何获得较纯的食盐晶体?
[查阅资料]
20℃时,部分物质的溶解性
情况如下表所示:
| OH- | CO32- |
Na+ | 溶 | 溶 |
Ca2+ | 微 | 不 |
Mg2+ | 不 | 微 |
[实验方案]按如下方案进行提纯粗盐。
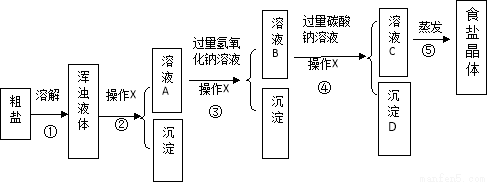
[解释与结论]
(1)实验操作X的名称是 ;沉淀D是 。
(2)为达到除去难溶性杂质的实验步骤是 。(填序号)
(3)实验步骤③的主要目的是 (用化学方程式回答);判断氢氧化钠溶液已过量的方法是 。
(4)在进行实验步骤⑤的蒸发时,为防止液体飞溅和获得相对更纯的食盐晶体需要进行的操作是 。
[反思与评价]
(5)有同学认为该实验方案并不完善,其理由及需补充的实验操作是 。
下列物质的用途与性质对应不正确的是
| 物 质 | 用 途 | 性 质 |
A | 二氧化碳 | 作气体肥料 | 二氧化碳既不燃烧也不支持燃烧 |
B | 熟石灰 | 改良酸性土壤 | 熟石灰能与酸发生中和反应 |
C | 小苏打 | 治疗胃酸过多 | 小苏打能与盐酸反应 |
D | 氮气 | 焊接金属时做保护气 | 氮气的化学性质不活泼 |



