题目内容
(11分)金属在生产生活中应用广泛。
(1)下图是铝的原子结构示意图。下列说法不正确的是 。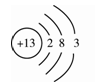
A.铝原子的质子数为13 B.化合物中铝元素通常显+3价
C.铝是地壳中含量最多的元素 D.铝可作导线是由于它具有良好的导电性
(2)21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程: 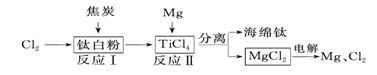
①反应Ⅰ在800~900 ℃的条件下进行,还生成一种可燃性无色气体,该反应的化学方程式为___ __;
②反应II可获得海锦钛,化学方程式表示为TiCl2+2Mg 高温Ti+2MgCl2。该反应属于
(填序号)。
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
③该工艺流程中,可循环利用的两种物质是 、 。
(3)现有铝、铁、铜、银四种金属相互转化关系如图所示。 试推理乙是 ;写出甲→丙反应的化学方程式 。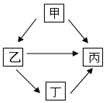
(4)向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示,下列说法正确的是 。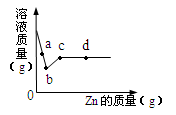
A.a点溶液中的溶质有4种
B.c点溶液中溶质为Zn(NO3)2
C.若取b~c段溶液,滴加稀盐酸,有白色沉淀
D.取d点的固体,加入稀盐酸,有气泡产生
(5)相同质量的锌、铁分别与稀盐酸作用,产生H2的质量m(H2)与加入稀盐酸的体积V(稀盐酸)关系如下图所示,其中正确的是 。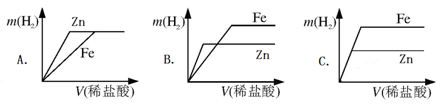
(1)C
(2)①2Cl2 + TiO2 + 2C TiCl4 + 2CO ②C ③Mg Cl2(3)铁; 2Al +3AgNO3
TiCl4 + 2CO ②C ③Mg Cl2(3)铁; 2Al +3AgNO3
=Al(NO3) 3+ 3Ag (4)BD (5)B
解析

 53随堂测系列答案
53随堂测系列答案(7分)使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放。
|
(3)制镁的原料MgO可从海水中获得。小华利用镁与盐酸反应后的废液,模拟从海水中获取MgO的过程,实验如下:
步骤1:向上述废液中,边搅拌边分批加入CaO,至MgCl2完全沉淀为止,过滤得Mg(OH)2固体。共消耗8.4g CaO。
步骤2:将Mg(OH)2固体加热分解为MgO和水,所得MgO的质量为4.0g 。
①步骤2中Mg(OH)2分解的化学方程式为 。
②通过所得MgO的质量计算上述废液中含MgCl2的质量m= g。
③分析实验数据,可知步骤Ⅰ中反生的化学反应有:
CaO+H2O==Ca(OH)2;Ca(OH)2+MgCl2==CaCl2+Mg(OH)2↓; 。