题目内容
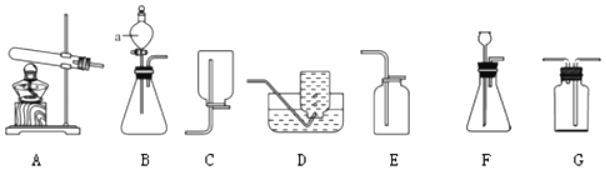
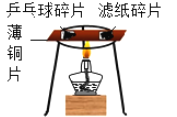
【题目】如图1是小忻同学设计的一套实验室制备纯净、干燥的CO2和验证CO2能与NaOH反应的装置。

(1)写出仪器a的名称:_____。
(2)在实验室中,制取二氧化碳的化学方程式为:_____,为制得二氧化碳,应选择图2装置_____填在A处。
(3)为获得纯净的二氧化碳,装置B中应放_____,(填字母)装置C中浓硫酸的作用是_____。
a.NaOH溶液 b.澄清石灰水 c.饱和的NaHCO3溶液 d.浓硫酸
(4)当装置E中收集满CO2时,关闭止水夹K1,打开止水夹K2,把注射器D中5mL浓NaOH溶液压入装置E中,发生反应的化学方程式为_____,观察到的现象是_____。小平同学认为要证明CO2与NaOH确实反应,还应把注射器NaOH溶液换成等体积的_____,再做一次实验。
(5)小红认为,我们还可以采用检验生成物的方法,确认CO2与NaOH反应了。于是,小玲同学取少量E中溶液于烧杯中,再向溶液中滴加几滴稀盐酸,未发现有气泡产生。据此现象小玲认为CO2与NaOH没有反应。你认为该结论是否正确,并说明理由_____。
(6)为了进一步得出结论,几位同学结合所学知识分工合作,集思广益,设计了下列实验进行验证。请将下表补充完整。
实验步骤 | 实验现象 | 实验结论 |
①取E中溶液,滴加过量CaCl2溶液 | _____ | CO2与NaOH能反应,且反应后的溶液中还有NaOH. |
②对①进行过滤,向滤液中滴加_____ | 溶液变红 |
(反思评价)
(1)在实验步骤①中为什么要加入过量的CaCl2溶液?_____。
(2)小玲同学认为在实验步骤①中可以用Ca(OH)2 溶液代替CaCl2证明这一瓶中是否含有NaOH,你认为呢?并说明理由_____。
【答案】铁架台; CaCO3+2HCl=CaCl2+CO2↑+H2O; H; c; 干燥二氧化碳; CO2+2NaOH=Na2CO3+H2O; 紫色石蕊溶液倒流至E中,溶液变为蓝色; 水; 不正确,滴加的稀盐酸过少,先与NaOH溶液发生反应; 有白色沉淀产生 酚酞溶液 除去碳酸钠,因为碳酸钠溶液液显碱性,影响下一步氢氧化钠的检验。 不可以,氢氧化钙与碳酸钠反应也生成氢氧化钠,影响下一步氢氧化钠的检验。
【解析】
(1)仪器a是铁架台;故填:铁架台;
(2)在实验室中,制取二氧化碳的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O,该反应属于固液常温型,选择装置H来制取;故填:CaCO3+2HCl=CaCl2+CO2↑+H2O;H;
(3)制取的二氧化碳常混有氯化氢气体,可通过饱和的NaHCO3溶液除去其中的氯化氢气体,浓硫酸具有吸水性,所以可用浓硫酸对二氧化碳进行干燥;故填:c;干燥二氧化碳;
(4)当装置E中收集满CO2时,关闭止水夹K1,打开止水夹K2,把注射器D中5mL浓NaOH溶液压入装置E中,二氧化碳与氢氧化钠发生了反应,反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O,由于瓶内的压强减小,观察到的现象是:烧杯中紫色的石蕊试液倒吸入E中,E中溶液显碱性,所以溶液变蓝。小平同学认为要证明CO2与NaOH确实反应,还应把注射器NaOH溶液换成等体积的水,再做一次实验进行对比分析;故填:CO2+2NaOH=Na2CO3+H2O;紫色石蕊溶液倒流至E中,溶液变为蓝色;水;
(3)小红认为,我们还可以采用检验生成物的方法,确认CO2与NaOH反应了。于是,小玲同学取少量E中溶液于烧杯中,再向溶液中滴加几滴稀盐酸,未发现有气泡产生。据此现象小玲认为CO2与NaOH没有反应。该结论不正确,少量的盐酸先跟氢氧化钠反应;故填:不正确,滴加的稀盐酸过少,先与NaOH溶液发生反应;
(4)由于碳酸钠能与氯化钙反应生成了碳酸钙沉淀,氢氧化钠溶液显碱性,所以为了证明溶液中含有碳酸钠和氢氧化钠,设计实验方案如下:
实验步骤 | 实验现象 |
①取E中溶液,滴加过量CaCl2溶液 | 有白色沉淀产生 |
②对①进行过滤,向滤液中滴加酚酞溶液 | 溶液变红 |
故填:有白色沉淀产生;酚酞溶液;
[反思评价](1)由于碳酸钠溶液液显碱性,影响下一步氢氧化钠的检验,所以在实验步骤①中要加入过量的CaCl2溶液将碳酸钠完全除去。
(2)由于氢氧化钙与碳酸钠反应也生成氢氧化钠,影响下一步氢氧化钠的检验,所以不可以在实验步骤①中可以用Ca(OH)2 溶液代替CaCl2证明这一瓶中是否含有NaOH。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案