题目内容
【题目】请回答下列与物质提纯有关的问题:
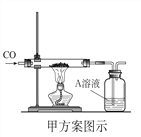
![]() 下列两个方案是除去铜粉中少量氧化铁的实验设计:
下列两个方案是除去铜粉中少量氧化铁的实验设计:
![]() 用盐酸除去氧化铁
用盐酸除去氧化铁 ![]() 用CO还原氧化铁.
用CO还原氧化铁.
简便易行的方案是______![]() 填序号
填序号![]() ,写出该反应的化学方程式______.
,写出该反应的化学方程式______.
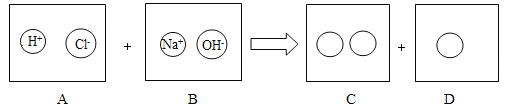
![]() 要除去
要除去![]() 溶液中少量NaOH不能选用稀盐酸,原因是会生成______而引入新的杂质.
溶液中少量NaOH不能选用稀盐酸,原因是会生成______而引入新的杂质.
![]() 要除去氢气中的少量水蒸气和氯化氢气体,将混合气体先通过足量的浓硫酸,再通过足量的氢氧化钠溶液后,氢气中仍含有的杂质是______.
要除去氢气中的少量水蒸气和氯化氢气体,将混合气体先通过足量的浓硫酸,再通过足量的氢氧化钠溶液后,氢气中仍含有的杂质是______.
【答案】![]()
![]() NaCl 水
NaCl 水
【解析】
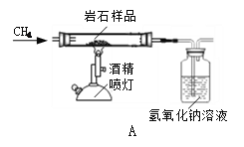
解:![]() 用盐酸除去铜粉中的氧化铁操作简便,且不会污染空气,用一氧化碳还原氧化铁会生成铁,还需要进一步和铜分离,且一氧化碳有毒,故此用盐酸除杂质,化学方程式为:
用盐酸除去铜粉中的氧化铁操作简便,且不会污染空气,用一氧化碳还原氧化铁会生成铁,还需要进一步和铜分离,且一氧化碳有毒,故此用盐酸除杂质,化学方程式为:![]() ;
;
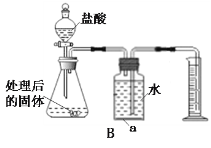
![]() 要除去
要除去![]() 溶液中少量NaOH不能选用稀盐酸,原因是会生成NaCl而引入新的杂质,化学方程式为
溶液中少量NaOH不能选用稀盐酸,原因是会生成NaCl而引入新的杂质,化学方程式为![]() ,可选择适量硫酸除去氢氧化钠杂质.
,可选择适量硫酸除去氢氧化钠杂质.
![]() 要除去氢气中的少量水蒸气和氯化氢气体,将混合气体先通过足量的浓硫酸,再通过足量的氢氧化钠溶液后,氢气会带出氢氧化钠溶液中的水蒸气,因此要先通过氢氧化钠溶液再通过浓硫酸.
要除去氢气中的少量水蒸气和氯化氢气体,将混合气体先通过足量的浓硫酸,再通过足量的氢氧化钠溶液后,氢气会带出氢氧化钠溶液中的水蒸气,因此要先通过氢氧化钠溶液再通过浓硫酸.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】如图1是小忻同学设计的一套实验室制备纯净、干燥的CO2和验证CO2能与NaOH反应的装置。
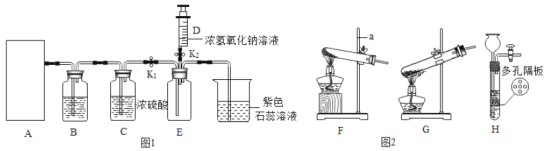
(1)写出仪器a的名称:_____。
(2)在实验室中,制取二氧化碳的化学方程式为:_____,为制得二氧化碳,应选择图2装置_____填在A处。
(3)为获得纯净的二氧化碳,装置B中应放_____,(填字母)装置C中浓硫酸的作用是_____。
a.NaOH溶液 b.澄清石灰水 c.饱和的NaHCO3溶液 d.浓硫酸
(4)当装置E中收集满CO2时,关闭止水夹K1,打开止水夹K2,把注射器D中5mL浓NaOH溶液压入装置E中,发生反应的化学方程式为_____,观察到的现象是_____。小平同学认为要证明CO2与NaOH确实反应,还应把注射器NaOH溶液换成等体积的_____,再做一次实验。
(5)小红认为,我们还可以采用检验生成物的方法,确认CO2与NaOH反应了。于是,小玲同学取少量E中溶液于烧杯中,再向溶液中滴加几滴稀盐酸,未发现有气泡产生。据此现象小玲认为CO2与NaOH没有反应。你认为该结论是否正确,并说明理由_____。
(6)为了进一步得出结论,几位同学结合所学知识分工合作,集思广益,设计了下列实验进行验证。请将下表补充完整。
实验步骤 | 实验现象 | 实验结论 |
①取E中溶液,滴加过量CaCl2溶液 | _____ | CO2与NaOH能反应,且反应后的溶液中还有NaOH. |
②对①进行过滤,向滤液中滴加_____ | 溶液变红 |
(反思评价)
(1)在实验步骤①中为什么要加入过量的CaCl2溶液?_____。
(2)小玲同学认为在实验步骤①中可以用Ca(OH)2 溶液代替CaCl2证明这一瓶中是否含有NaOH,你认为呢?并说明理由_____。
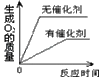
【题目】下列四个图象反映出对应实验过程中相关量的变化,其中正确的是( )
|
|
|
|
A.一定质量木炭在足量氧气中燃烧 | B.加热一定量的高锰酸钾制取氧气 | C.用相等量的氯酸钾来制取氧气 | D.电解水 |
A. AB. BC. CD. D
【题目】某校兴趣小组在实验室中完成制取氧气的实验。他们取氯酸钾和二氧化锰的混合物共3.0g放入大试管中加热,并在不同时刻测定试管内剩余固体物质的质量(如表):
分析表中数据,完成下列问题:
反应时间/min | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
剩余固体质量/g | 2.55 | 2.25 | 2.10 | 2.04 | 2.04 |
(1)加热到_____min,氯酸钾已经完全分解;
(2)完全反应后,生成氧气的质量为_____g;
(3)原混合物中氯酸钾的质量是多少_____?