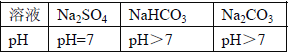题目内容
【题目】(13分)某品牌纯碱中含有少量氯化钠.某化学探究小组欲测定该品牌纯碱的纯度(即碳酸钠的质量分数)。
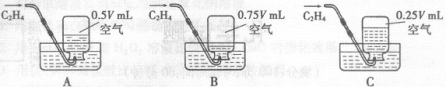
Ⅰ.甲组同学设计如图所示实验:

【实验步骤】①组装好如图仪器,并 ;
②称取7.0g样品放入锥形瓶中,加入少量蒸馏水溶解,并在其他装置中加入相应的药品;
③称量装置C的质量;
④打开分液漏斗旋塞滴入稀硫酸,直到不再产生气泡为止;
⑤再次称量装置C 的总质量; ⑥计算出样品中碳酸钠的质量分数。
【实验分析】(1)A装置中反应的化学方程式为 ;
(2)B装置的作用是 ;
(3)如果没有D装置则所测样品中碳酸钠的质量分数偏大的原因是 ;
(4)称得纯碱样品的质量为7.0g,实验前、后C装置(包含药品)的质量分别为61.2g和63.4g,则该纯碱样品的纯度为 (计算结果精确到0.1%)。
Ⅱ.乙组同学采用生成沉淀的方法来测定样品中纯碱的质量分数,设计了如下实验:
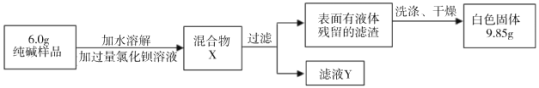
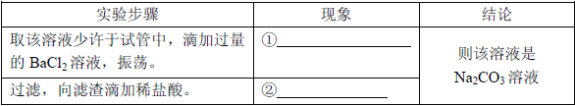
(1)判断加入氯化钡溶液是否过量的合适方法是 (填编号),然后观察现象判断。
A.向混合物X中滴加稀硫酸,若有白色沉淀生成则说明氯化钡已经过量
B.静置混合物X,向上层清液中继续滴加氯化钡溶液,若无白色沉淀生成,则氯化钡已经过量
(2)判断滤渣是否洗涤干净,可以采取向最后的洗出液中滴加 ,然后观察现象判断。
(3)根据实验数据,乙组测得样品中碳酸钠的质量分数为多少?(写出计算过程,计算结果精确到0.1%)。
【实验反思】乙组所测实验数据比甲组更准确,你认为甲组存在较大偏差的原因可能是 。
【答案】Ⅰ.【实验步骤】检查装置气密性
【实验分析】(1)Na2CO3+H2SO4=Na2SO4+H2O+CO2↑(2)吸收水蒸气(3)空气中的二氧化碳和水蒸气会进入C装置中(4)75.7%
Ⅱ.(1)A (2)硝酸银溶液(3)88.3%
【实验反思】因甲组实验中生成的二氧化碳有部分残留在锥形瓶中,未被装置C吸收,影响实验测定
【解析】
试题分析:①组装好如图仪器,并检查装置气密性,防止装置漏气,A装置中反应的化学方程式为Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;B装置的作用是吸收水蒸气,因为浓硫酸具有吸水性;根据质量的变化看过程中产生的二氧化碳的质量=63.4克-61.2克=2.2克,设产生二氧化碳的质量为2.2克,需要碳酸钠的质量为X,
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
X 2.2克
解得X=5.3克 则该纯碱样品的纯度为=5.3克/7.0克×100%=75.7%;
氯化钡溶液是否过量就是判断混合物X中是否有氯化钡,所以应向混合物X中滴加稀硫酸,若有白色沉淀生成则说明氯化钡已经过量(注:B的方法只能证明氯化钡是否足量,但不能证明是否过量);判断滤渣是否洗涤干净,可以采取向最后的洗出液中滴加硝酸银溶液,看是否有沉淀产生;解:设纯碱样品中碳酸钠的质量为x。
Na2CO3+BaCl2=BaCO3↓+2NaC
106 197
x 9.85 g
106︰197= x︰9.85 g
X=5.3 g
纯碱样品中碳酸钠的质量分数=5.3g/6g×100%=88.3%
乙组所测实验数据比甲组更准确,你认为甲组存在较大偏差的原因可能是:因甲组实验中生成的二氧化碳有部分残留在锥形瓶中,未被装置C吸收,影响实验测定

 导学教程高中新课标系列答案
导学教程高中新课标系列答案