题目内容
【题目】在实验探究课上,老师给了同学们一包红色粉末,该粉末是铜粉和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究并回答问题.
(1).(提出问题)假设l:红色粉末是铜粉;假设2:红色粉末是氧化铁粉;
假设3:红色粉末是_____
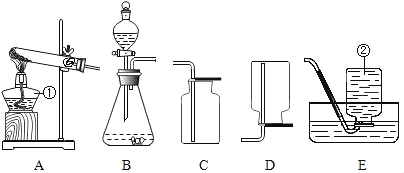
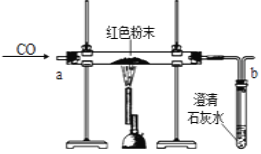
(2).(设计实验方案)同学们对实验作了如下设想和分析:取少量红色粉末放入硬质玻璃管中,通入一氧化碳片刻后加热至充分反应(实验装置如图所示).
请你完成下表:
实验中可能出现的现象 | 结论 |
红色粉末不变色,石灰水不变浑浊 | 假设1成立 |
_____ | 假设2成立 |
_____ | 假设3成立 |
(3)(进行实验)通过实验及分析,确认假设3成立.
(4).(反思与评价)
①实验过程中,硬质玻璃管内发生反应的化学方程式是_____
②实验时通入一氧化碳片刻后再加热的原因是_____
③从环保角度看,上面的实验装置有不足之处,请你对该装置进行改进,具体措施是_____
(5)(拓展)根据你最近所学的知识,请再设计一种实验方案确认假设3成立.
操作方法 | 预计实验现象 | 有关化学方程式 |
_____ | _____ | _____ |
【答案】铜粉和氧化铁粉的混合物 红色粉末全部变为黑色,石灰水变浑浊 红色粉末部分变为黑色,石灰水变浑浊 3CO+Fe2O3![]() 2Fe+3CO2 排尽装置中的空气,防止加热时硬质玻璃管发生爆炸 在b处用酒精灯点燃,或用塑料袋(气球)收集 取少量红色粉末于试管中,加入足量的稀盐酸或者稀硫酸 固体部分溶解,溶液由无色变为黄色 6HCl+Fe2O3=2FeCl3+3H2O
2Fe+3CO2 排尽装置中的空气,防止加热时硬质玻璃管发生爆炸 在b处用酒精灯点燃,或用塑料袋(气球)收集 取少量红色粉末于试管中,加入足量的稀盐酸或者稀硫酸 固体部分溶解,溶液由无色变为黄色 6HCl+Fe2O3=2FeCl3+3H2O
【解析】
(1)[提出问题]根据题意可知,红色粉末是铜粉和氧化铁中的一种或两种,则可得假设l:红色粉末是铜粉;假设2:红色粉末是氧化铁粉;假设3:红色粉末是铜粉和氧化铁粉的混合物;故填:铜粉和氧化铁粉的混合物
(2)[设计实验方案]对实验作了如下设想和取少量红色粉末放入硬质玻璃管中,通入一氧化碳片刻后加热至充分反应:若红色粉末不变色,石灰水不变浑浊,则说明红色粉末为铜粉,假设1成立;若红色粉末全部变成黑色,石灰水变浑浊,则说明粉末为氧化铁,假设2成立;若红色粉末部分变黑色,部分仍为红色,则说明粉末为氧化铁和铜粉的混合物,则假设3成立;实验与结论如下表:
实验中可能出现的现象 | 结论 |
红色粉末不变色,石灰水不变浑浊 | 假设1成立 |
红色粉末全部变为黑色,石灰水变浑浊 | 假设2成立 |
红色粉末部分变为黑色,石灰水变浑浊 | 假设3成立 |
故填:红色粉末全部变为黑色,石灰水变浑浊;红色粉末部分变为黑色,石灰水变浑浊
(4)[反思与评价]
①实验过程中,根据(3)得知假设3成立,硬质玻璃管内是一氧化碳把氧化铁给还原了,生成二氧化碳和铁,其发生反应的化学方程式是3CO+Fe2O3![]() 2Fe+3CO2;故填:3CO+Fe2O3
2Fe+3CO2;故填:3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
②因为一开始装置内有较多的空气,一氧化碳在有氧气存在的情况下加热会发生爆炸,实验时通入一氧化碳片刻,把里面的空气排出来,再加热;故填:排尽装置中的空气,防止加热时硬质玻璃管发生爆炸
③从环保角度看,上面的实验装置有一个不足之处是没有进行尾气处理,因此需要对尾气进行处理,可以采取的方法是:在b处用酒精灯点燃,或用塑料袋(气球)收集;故填:在b处用酒精灯点燃,或用塑料袋(气球)收集
(5)[拓展]设计实验证明假设3成立。可以取少量红色粉末于试管中,加入足量的稀盐酸或者稀硫酸;若有固体部分溶解,溶液由无色变为黄色,发生的化学反应方程式为:6HCl+Fe2O3=2FeCl3+3H2O;则证明固体粉末是铜粉和氧化铁粉的混合物。
实验设计如下表:
操作方法 | 预计实验现象 | 有关化学方程式 |
取少量红色粉末于试管中,加入足量的稀盐酸或者稀硫酸 | 固体部分溶解,溶液由无色变为黄色 | 6HCl+Fe2O3=2FeCl3+3H2O |
故填:取少量红色粉末于试管中,加入足量的稀盐酸或者稀硫酸;固体部分溶解,溶液由无色变为黄色;6HCl+Fe2O3=2FeCl3+3H2O

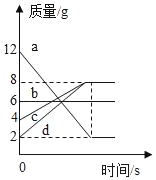
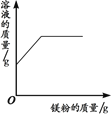
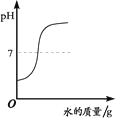
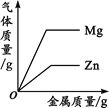
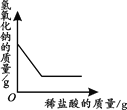
【题目】下列四个图像中,能正确反映对应变化关系的是( )
|
|
|
|
A.向一定量的稀盐酸中加入过量的镁粉 | B.向一定量的稀盐 | C.向两份完全相同的稀盐酸中分别加入锌粉、镁粉 | D.向一定量氢氧化钠溶液中滴加稀盐酸 |
A. AB. BC. CD. D