题目内容
【题目】在一密闭容器中,a、b、c、d四种物质在一定条件下发生化学反应,反应前后各物质质量变化如图,下列说法错误的是( )
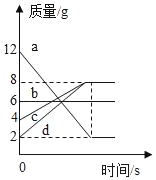
A. 该反应是分解反应
B. b可能是催化剂
C. 反应前后物质的总质量保持不变
D. 反应生成的c和d质量相等
【答案】D
【解析】
反应后质量增加的属于生成物,反应后质量减少的属于反应物,反应后质量不变可能属于催化剂,进行分析判断。
由图中数据分析可知,反应前后a的质量减少了12g-2g=10g,故a是反应物;同理可以确定b的质量不变,可能作该反应的催化剂,也可能没有参加反应;c是生成物,生成的质量为8g-4g=4g;d是生成物,生成的质量为8g-2g=6g。
A、该反应的反应物为是a,生成物是c和d,符合“一变多”的形式,属于分解反应,故选项说法正确;
B、b的质量不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法正确;
C、化学反应遵守质量守恒定律,反应前后物质的总质量保持不变,故选项说法正确;
D、反应生成的c和d质量分别是4g、6g,不相等,故选项说法错误。
故选:D。

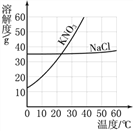
【题目】NaCl在生产和生活中具有广泛的用途,是一种重要的资源。通过晾晒海水可以得到粗盐和母液(又叫苦卤)。下图为母液中最主要的四种盐(NaCl、KCl、MgCl2、MgSO4)的溶解度曲线图。回答下列问题:

(1)①90℃时,四种盐中MgCl2的溶解度最大,则表示MgCl2溶解度曲线的是_________。(填“A”或“B”)此时饱和MgCl2溶液的质量分数为_______
(请写出计算表达式即可)
②四种盐中溶解度受温度变化的影响最小的是_____________。(填化学式)
(2)60℃时,若母液中的NaCl、KCl、MgCl2、MgSO4都已达到饱和,为了获得较纯净的MgSO4晶体,可采用的最好方法是_______________。
(3)工业上常通过加入碱溶液与母液中的Mg2+反应来制取Mg(OH)2沉淀。为了探究获得较高Mg2+沉淀率的反应条件,进行下列对比实验(每组实验取250mL母液)
实验序号 | 反应温度/℃ | 反应时间/min | 反应pH值 | Mg2+的沉淀率/% |
a | 40 | 60 | 10 | 90.1 |
b | 40 | 60 | 12 | 92.7 |
c | 40 | 90 | 12 | 93.6 |
d | 50 | 60 | 12 | 96.4 |
e | 50 | 90 | 12 | X |
①本实验研究了哪些因素对Mg2+的沉淀率的影响_______
②实验a和b对比,可得到的结论是_______
③表格中x的数值可能为__________(填字母)。
A 95.8 B 92.1 C 97.2 D 93.1
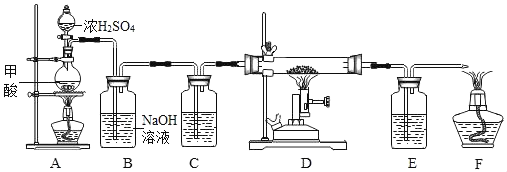
【题目】在实验探究课上,老师给了同学们一包红色粉末,该粉末是铜粉和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究并回答问题.
(1).(提出问题)假设l:红色粉末是铜粉;假设2:红色粉末是氧化铁粉;
假设3:红色粉末是_____
(2).(设计实验方案)同学们对实验作了如下设想和分析:取少量红色粉末放入硬质玻璃管中,通入一氧化碳片刻后加热至充分反应(实验装置如图所示).
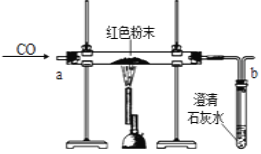
请你完成下表:
实验中可能出现的现象 | 结论 |
红色粉末不变色,石灰水不变浑浊 | 假设1成立 |
_____ | 假设2成立 |
_____ | 假设3成立 |
(3)(进行实验)通过实验及分析,确认假设3成立.
(4).(反思与评价)
①实验过程中,硬质玻璃管内发生反应的化学方程式是_____
②实验时通入一氧化碳片刻后再加热的原因是_____
③从环保角度看,上面的实验装置有不足之处,请你对该装置进行改进,具体措施是_____
(5)(拓展)根据你最近所学的知识,请再设计一种实验方案确认假设3成立.
操作方法 | 预计实验现象 | 有关化学方程式 |
_____ | _____ | _____ |