题目内容
【题目】(1)下表是生活饮用水国家标准的部分内容。
生活饮用水水质常规检验项目及限值(部分)
项目 | 限值 |
色度 | 不超过15度,并不得呈现其他异色 |
浑浊度 | 不超过1度,特殊情况下不超过5度 |
pH | 6.5~8.5 |
总硬度(以CaCO3计) | 450mg/L |
铝 | 0.2mg/L |
铁 | 0.3mg/L |
硫酸盐 | 250mg/L |
①上表中“铝”指的是_______(选填“单质”“元素”或“原子”)。
②生活中硬水软化的方法是___________。
③Cl2、ClO2均可作自来水消毒剂,其中氯元素的化合价分别是____________。
④1L合格的生活饮用水中,均以CaCO3计算硬度,则钙元素的含量不超过_____mg/L。
⑤实验室用上述水样通电分解,产生氢气和氧气的体积比约为______;反应的化学方程式为______。
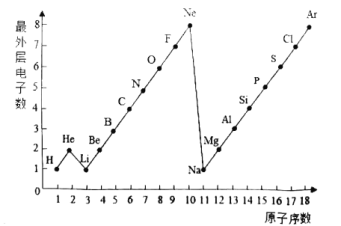
(2)元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排布:
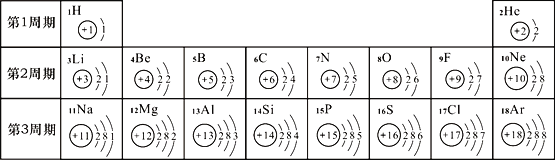
请回答下列问题:
①第17号元素属于______元素(填“金属”或“非金属”),其次外层电子数为______。
②元素的化学性质与原子结构中的_____数关系密切;在同一族中,各元素的原子结构呈现的规律有____(任写一点)。
③地壳中含量最多的金属元素与含量最多的非金属元素组成的化合物为____________。第16号元素在化学反应中容易形成________(填离子符号),该元素的单质在氧气中燃烧的现象是_______________。
【答案】元素 煮沸 0价、+4价 180 2:1 2H2O![]() 2H2↑+O2↑ 非金属 8 最外层电子 最外层电子数相等或由上而下电子层数依次递增 氧化铝 S2- 剧烈燃烧,发出明亮的蓝紫色火焰,产生有刺激性气味的气体
2H2↑+O2↑ 非金属 8 最外层电子 最外层电子数相等或由上而下电子层数依次递增 氧化铝 S2- 剧烈燃烧,发出明亮的蓝紫色火焰,产生有刺激性气味的气体
【解析】
(1)①上表中“铝”指的是元素;
②生活中硬水软化方法是加热煮沸,在实验室中是蒸馏;
③Cl2、ClO2均可作自来水消毒剂,其中氯元素的化合价分别是:0价、+4价;
④1L合格的生活饮用水中,均以CaCO3计算硬度,则钙元素的含量不超过:450mg×![]() =180mg;
=180mg;
⑤实验室用上述水样通电分解,生成氢气和氧气,2H2O![]() 2H2↑+O2↑;其中氢气和氧气的体积比是2:1;
2H2↑+O2↑;其中氢气和氧气的体积比是2:1;
(2)①第17号元素是氯元素,氯元素属于非金属元素,其次外层电子数为8;
②元素的化学性质与原子结构中的最外层电子数关系密切;在同一族中,各元素的原子结构呈现的规律有:最外层电子数相等,由上而下电子层数依次递增;
③地壳中含量最多的金属元素是铝元素,与含量最多的非金属元素--氧元素组成的化合物为氧化铝;第16号元素是硫元素,硫原子最外层电子数是6,在化学反应中容易得到2个电子形成带2个单位负电荷的S2-;硫在氧气中燃烧的现象是剧烈燃烧,发出明亮的蓝紫色火焰,产生有刺激性气味的气体。

 走进文言文系列答案
走进文言文系列答案【题目】通过分析实验结果推断物质的组成是认识物质的一种方法。研究水的组成就是利用了这种方法。电解水实验结果如图所示:
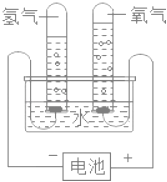
(1)经检验,电解水只生成了氢气和氧气,确定了水是由_____和_____组成的结论,得出此结论的依据是_____。
(2)已知相同状况下,相同体积的任何气体具有相同数目的分子。由于电解水时生成氢气和氧气的体积比为2:1,推求出水分子中_____和_____的个数比为2:1,经进一步科学确认,得出水的化学式为H2O。
(3)电解水的化学方程式为_____;该反应中生成的氢气和氧气的质量比为_____。
(4)相同条件下,氢气和氧气在水中的溶解能力是不相同的,每100g水中最多可以溶解气体的质量如下:
气 体 | 氢 气 | 氧 气 |
每100g水中最多可以溶解气体的质量 | 1.63×10﹣3g | 4.34×10﹣3g |
则相对更易溶于水的气体是_____;由此你认为在水的电解过程中,生成氢气、氧气的体积比可能_____2:1(填“大于”或“小于”)。