题目内容
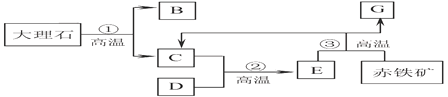
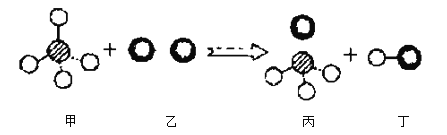
【题目】工业生产氟化钠(NaF)的主要流程如下(整个过程中水不参加反应):
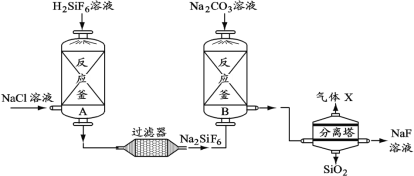
(1)H2SiF6中氟元素(F)的化合价为-1,则硅元素(Si)的化合价为_______;
(2)产物气体X是初中化学常见气体,其组成元素为_______(填元素符号);
(3)产物NaF中的钠元素来自于原料中的_______(填物质的化学式)。
【答案】+4 C、O NaCl、Na2CO3
【解析】
(1)氢元素显+1价,氟的化合价为-1,设硅元素的化合价是x,根据在化合物中正负化合价代数和为零可得:(+1)×2+x+(-1)×6=0,则x=+4,故硅的化合价为+4价;
(2)碳酸钠和Na2SiF6反应,生成二氧化硅、氟化钠和气体X,产物气体X是初中化学常见气体,由质量守恒定律,反应前后元素种类不变,可知X的组成元素为碳元素、氧元素元素符号为C、O。
(3)由质量守恒定律,反应前后元素种类不变,产物NaF中的钠元素来自于原料中的NaCl和Na2CO3。

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】(1)下表是生活饮用水国家标准的部分内容。
生活饮用水水质常规检验项目及限值(部分)
项目 | 限值 |
色度 | 不超过15度,并不得呈现其他异色 |
浑浊度 | 不超过1度,特殊情况下不超过5度 |
pH | 6.5~8.5 |
总硬度(以CaCO3计) | 450mg/L |
铝 | 0.2mg/L |
铁 | 0.3mg/L |
硫酸盐 | 250mg/L |
①上表中“铝”指的是_______(选填“单质”“元素”或“原子”)。
②生活中硬水软化的方法是___________。
③Cl2、ClO2均可作自来水消毒剂,其中氯元素的化合价分别是____________。
④1L合格的生活饮用水中,均以CaCO3计算硬度,则钙元素的含量不超过_____mg/L。
⑤实验室用上述水样通电分解,产生氢气和氧气的体积比约为______;反应的化学方程式为______。
(2)元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排布:
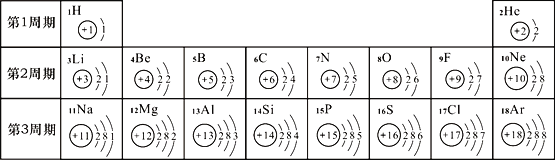
请回答下列问题:
①第17号元素属于______元素(填“金属”或“非金属”),其次外层电子数为______。
②元素的化学性质与原子结构中的_____数关系密切;在同一族中,各元素的原子结构呈现的规律有____(任写一点)。
③地壳中含量最多的金属元素与含量最多的非金属元素组成的化合物为____________。第16号元素在化学反应中容易形成________(填离子符号),该元素的单质在氧气中燃烧的现象是_______________。