题目内容
【题目】有一包白色固体样品,可能由CaCO3、NaOH、MgCl2、Na2SO4和BaCl2中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验。
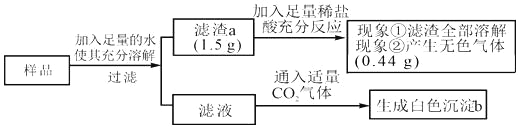
下列判断正确的是( )
A. 原固体样品中一定有CaCO3、NaOH、MgCl2、BaCl2,可能有Na2SO4
B. 滤液中溶质的成分是NaOH、BaCl2
C. 滤渣a的成分是CaCO3
D. 若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,则原样品中仍能确定是否存在MgCl2
【答案】B
【解析】
根据碳酸钙难溶于水,钡离子和硫酸根离子会生成硫酸钡沉淀,氢氧化钠和氯化镁反应会产生氢氧化镁沉淀,碳酸钙和盐酸反应会生成二氧化碳气体,结合化学方程式计算等知识进行分析。
A、样品溶于水得到滤渣1.5g,能够全部溶于稀盐酸,且产生0.44g的二氧化碳,说明沉淀一定含有碳酸钙,一定没有硫酸钡,若固体存在BaCl2,BaCl2与Na2SO4反应生成硫酸钡和氯化钠,则一定无硫酸钠,错误;B、二氧化碳和氢氧化钠反应产生碳酸钠,碳酸钠和氯化钡反应产生的碳酸钡沉淀。滤液通入二氧化碳产生沉淀,说明滤液中溶质的成分除氯化钠还有氢氧化钠和氯化钡,正确;C、设:产生0.44g的二氧化碳需要碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 0.44g
则 ![]() ,解得x=1g,1g<1.5g,因此沉淀还有氢氧化镁;沉淀a是碳酸钙和氢氧化镁,错误;D、现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,可以知道沉淀a一定含有碳酸钙和硫酸钡沉淀,不一定含有氢氧化镁沉淀,无法确定氯化镁的存在,错误。故选B。
,解得x=1g,1g<1.5g,因此沉淀还有氢氧化镁;沉淀a是碳酸钙和氢氧化镁,错误;D、现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,可以知道沉淀a一定含有碳酸钙和硫酸钡沉淀,不一定含有氢氧化镁沉淀,无法确定氯化镁的存在,错误。故选B。

【题目】黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10g粉末状黄铜样品放入烧杯中,量取45mL稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | |
加入稀硫酸的体积(mL) | 15 | 15 | 15 |
生成氢气的质量(g) | m | 0.04 | 0.02 |
试求:
(1)m的数值_____。
(2)此黄铜样品中铜的质量分数是少?_____(写出计算过程)
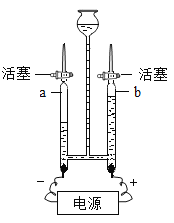
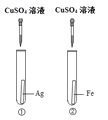
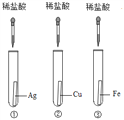
【题目】为探究铁、铜、银三种金属的活动性顺序,设计了A、B两个方案。请从两个方案中任选1个作答,若两个均作答,按方案A计分。
方案A | 方案B |
|
|
(1)实验中发生反应的化学方程式为______。 (2)实验中观察到的现象是______。 (3)该方案______(填“能”或“不能”)验证三种金属的活动性。 | (1)实验中发生反应的化学方程式为______。 (2)实验中观察到的现象是______。 (3)该方案______(填“能”或“不能”)验证三种金属的活动性。 |
【题目】探究反应物浓度对硫代硫酸钠(Na2S2O3)与硫酸反应速率的影响。
(查阅资料)
a Na2S2O3易溶于水,能与硫酸发生反应:![]()
b 浊度计用于测量浑浊度。产生的沉淀越多,浑浊度(单位为NTU)值越大。
(实验过程)
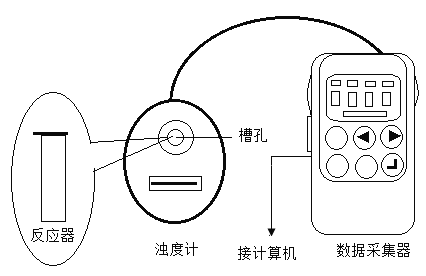
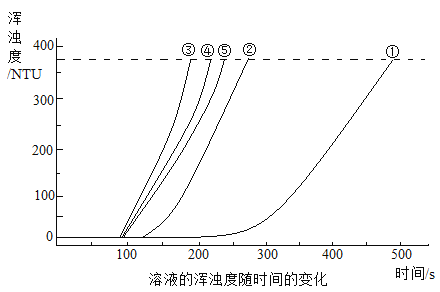
20℃时,用图所示装置进行如下表所示的5个实验,分别测量混合后溶液达到相同浑浊度的过程中,浑浊度随时间的变化。实验①~⑤所得数据如图所示。
实验编号 | 1.6% Na2S2O3溶液体积/ mL | 1% H2SO4溶液体积/ mL | 水体积/ mL |
① | 1.5 | 3.5 | 10 |
② | 2.5 | 3.5 | 9 |
③ | 3.5 | 3.5 | x |
④ | 3.5 | 2.5 | 9 |
⑤ | 3.5 | 1.5 | 10 |
注:所用溶液的密度均按1 g/mL计。
(解释与结论)
(1)选用浊度计进行测量,原因是Na2S2O3溶液与H2SO4溶液反应生成了_______。
(2)实验①~⑤中,反应速率最快的是_______(填实验编号)。
(3)实验③中,x=_______。
(4)实验①、②、③的目的是_______。
(5)比较①、②、③与③、④、⑤两组实验,可推断:改变_______(填“A”或“B”)对Na2S2O3与硫酸反应速率的影响更大。
A Na2S2O3溶液浓度
B H2SO4溶液浓度
你推断的证据是_______。