题目内容
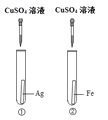
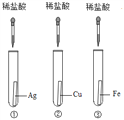
【题目】为探究铁、铜、银三种金属的活动性顺序,设计了A、B两个方案。请从两个方案中任选1个作答,若两个均作答,按方案A计分。
方案A | 方案B |
|
|
(1)实验中发生反应的化学方程式为______。 (2)实验中观察到的现象是______。 (3)该方案______(填“能”或“不能”)验证三种金属的活动性。 | (1)实验中发生反应的化学方程式为______。 (2)实验中观察到的现象是______。 (3)该方案______(填“能”或“不能”)验证三种金属的活动性。 |
【答案】 Fe +CuSO4 = FeSO4 + Cu ①中无明显变化,②中铁片表面覆盖一层红色物质,溶液由蓝色变成浅绿色 能 Fe + 2HCl= FeCl2 + H2↑ ①②中均无明显变化,③中有气泡冒出,溶液由无色变成浅绿色 不能
【解析】方案A(1)根据铁和硫酸铜反应生成铜和硫酸亚铁解答;
(2)①中银不与硫酸铜反应;
②中根据铁和硫酸铜反应的现象解答;
(3)根据实验方案分析解答;
方案B(1)根据稀盐酸与铁反应生成氯化亚铁和氢气解答;
(2)银、铜不与稀盐酸反应,铁与稀盐酸反应生成氢气和氯化亚铁,氯化亚铁溶液呈浅绿色;
(3)根据实验方案分析。
解:方案A(1)Fe +CuSO4 = FeSO4 + Cu;
(2)①中银不与硫酸铜反应,故①中无明显变化,②中铁和硫酸铜反应生成铜和硫酸亚铁,铜是红色,硫酸亚铁是浅绿色。故实验中观察到的现象是①中无明显变化,②中铁片表面覆盖一层红色物质,溶液由蓝色变成浅绿色 ;
(3)①中银不与硫酸铜反应,说明银的活动性比铜弱;②中铁和硫酸铜反应,说明铁的活动性比铜强。故该方案能验证三种金属的活动性。故填:能;
方案B(1)银、铜不与稀盐酸反应,铁与稀盐酸反应生成氢气和氯化亚铁,实验中发生反应的化学方程式为Fe + 2HCl= FeCl2 + H2↑;
(2)银、铜不与稀盐酸反应,铁与稀盐酸反应生成氢气和氯化亚铁,氯化亚铁溶液呈浅绿色。实验中观察到的现象是①②中均无明显变化,③中有气泡冒出,溶液由无色变成浅绿色;
(3)铁与稀盐酸反应,说明铁活动性比氢强。银、铜不与稀盐酸反应,说明银、铜活动性比氢弱,但银与铜的活动性无法比较。故该方案不能验证三种金属的活动性。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】某小组同学用不同长度的光亮镁条分别与4 mL 5%的稀盐酸反应,实验现象记录如下。
试管 | A | B | C | D |
镁条长度 | 1 cm | 2 cm | 3 cm | 4 cm |
实验现象 | 产生大量气泡,镁条溶解 | |||
无沉淀 | 少量灰白色沉淀 | 较多量灰白色沉淀 | 大量灰白色沉淀 | |
【提出问题】灰白色沉淀是什么?实验中为什么出现了灰白色沉淀?
【查阅资料】氢氧化镁[Mg(OH)2]难溶于水,Mg(OH)2 ![]() MgO + H2O
MgO + H2O
【猜想与假设】
Ⅰ. 灰白色沉淀可能是析出的氯化镁。
Ⅱ. 灰白色沉淀可能是生成的氢氧化镁。
【进行实验】
实验 | 实验操作 | 实验现象 |
1 | ① 取一定量上述实验中灰白色沉淀放入试管中,然后加入 5mL 蒸馏水,振荡、静置 ② 取等量氯化镁固体放入另一支试管中,加5mL蒸馏水,振荡 | ① 中固体量未减少 ② 中固体全部溶解得到澄清溶液 |
2 | 取上述实验中灰白色沉淀,用蒸馏水洗涤、室温晾干,放入试管中进行加热,试管口用湿润的紫色石蕊试纸检验 | 紫色石蕊试纸变红 |
3 | ① 在1支试管放入一小段光亮的镁条,加入 5mL 蒸馏水 ② 再向试管中加入几滴氯化镁饱和溶液 | ① 中无明显现象 ② 中镁条表面立即持续产生细小气泡并不断溶解,一段时间后镁条全部溶解,有大量灰白色沉淀 |
实验4:测定反应过程中溶液的pH变化。
在小烧杯中放入约 50 mL 质量分数为0.5% 稀盐酸,然后加入10 cm 光亮的镁条,现象及数据如下表所示。
时间/min | 0 | 48 | 77 | 85 | 87 | 95 | 100 |
溶液pH | 2 | 3 | 5.2 | 7.2 | 8.6 | 9.1 | 10.6 |
实验现象 | 大量气泡 | 镁条表面变暗,气泡减小 | 镁条表面变灰,有沉淀生成,并逐渐增多 | ||||
【解释与结论】
(1)试管A中,镁与稀盐酸反应的化学方程式为_______。
(2)猜想与假设Ⅰ不成立,其原因是_______。
(3)根据上述实验得出的下列结论中,正确的是________(填序号)。
A.灰白色固体不是氢氧化镁
B.镁条的用量偏多导致沉淀产生
C.灰白色固体受热产生酸性物质
(4)根据实验4,你认为产生灰白色沉淀的条件是________。
【反思与评价】
(5)经过进一步实验,灰白色沉淀中含有镁、氯、氢、氧四种元素。实验3中产生灰白色沉淀是因为镁与________反应生成的。
(6)通过本实验,今后再遇到化学反应中的异常现象时,可以从______角度分析原因(答出一条即可)。