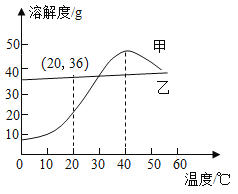
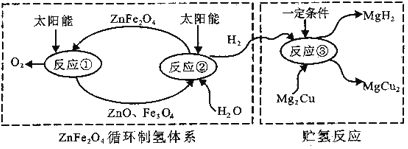
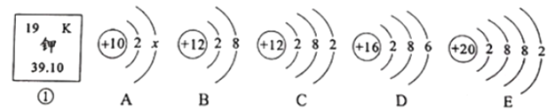
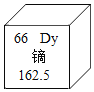
题目内容
【题目】今年“五·一”假期,小丽随爸爸到乡下省亲,期间看到许多漂亮的大理石,于是好带了一些回来,想去学校实验室测定这此大理石中CaCO3的含量。他称取了20克大理石样品置于烧杯中,然后将250g稀盐酸分成五等份,依次加入烧杯充分反应,记录有关实验数据如下表所示(大理石中其他分均不溶于水,也不参与化学反应)。
加入次数 | 一 | 二 | 三 | 四 | 五 |
加入稀盐酸的质量 | 50 | 50 | 50 | 50 | 50 |
烧杯中剩余固体的质量 | 15 | 10 | 5 | 5 | m |
试求:(1)m的值应为_____;
(2)实验中大理石样品所含CaCO3的质量分数?_____
(3)实验中所用稀盐酸的溶质质量分数?_____
【答案】5 75% 7.3%
【解析】
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,由表格数据可知,第一次,剩余固体的质量为15g,反应了5g,第二次,剩余固体的质量为10g,反应了5g,第三次,剩余固体的质量为5g,反应了5g,第三次,剩余固体的质量为5g,不再减少,则说明反应完全。
(1)由表格数据可知,第一次,剩余固体的质量为15g,反应了5g,第二次,剩余固体的质量为10g,反应了5g,第三次,剩余固体的质量为5g,反应了5g,第三次,剩余固体的质量为5g,不再减少,则说明反应完全,故m的值应为5g。
(2)根据质量守恒定律,反应前的总质量等于反应后的总质量,第三次,剩余固体的质量为5g,不再减少,则说明反应完全,故反应的碳酸钙的质量为![]() ,故实验中大理石样品所含CaCO3的质量分数为
,故实验中大理石样品所含CaCO3的质量分数为![]() 。
。
(3)设实验中所用稀盐酸的溶质质量分数为x
第三次,剩余固体的质量为5g,不再减少,则说明反应完全,消耗的稀盐酸的质量为150g,反应的碳酸钙的质量为![]() 。
。

![]()
![]()
答:实验中大理石样品所含CaCO3的质量分数为75%,实验中所用稀盐酸的溶质质量分数为7.3%。

 名校课堂系列答案
名校课堂系列答案