题目内容
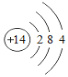
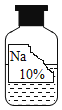
【题目】课外小组同学在实验室发现了一瓶标签残缺的无色液体(如图),想通过探究确定其成分,以便重新利用。
(查阅资料)初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。有关四种物质的信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
20oC溶解度/g | 36 | 109 | 21.5 | 9.6 |
水溶液的pH | 7 | 14 | 11 | 9 |
(实验探究)(1)为确定该溶液的成分,小明设计了如下图所示的实验过程:
实验操作 | 实验现象 | 实验结论 |
①取少量样品于试管中, 滴加酚酞试液 | 溶液变红 | 该溶液不可能是______溶液。 |
②向上述试管中,滴加稀盐酸 | 有气泡产生,溶液由红色逐渐变为无色 | 该溶液不可能是_______溶液。 |
(得出结论)通过以上活动,小明认为瓶中的试剂是碳酸钠溶液,不是碳酸氢钠溶液,理由是____________。
(2)小明和小红将实验后的废液倒入同一个烧杯中,小红取少量瓶中的试剂于试管中,向试管中滴加澄清石灰水,充分反应后,与小明所得溶液混合,静置后发现:上层为无色透明的溶液,底部有白色沉淀。则上层溶液中一定含有的溶质是_______(酸碱指示剂除外),可能含有的溶质是___________。
【答案】氯化钠 氢氧化钠 室温时,碳酸氢钠的溶解度是9.6g,即使是饱和溶液,溶质质量分数也小于10% 氯化钠 氯化钙
【解析】
显碱性溶液能使酚酞试液变红色,显中性溶液和显酸性溶液都不能使酚酞试液变色;稀盐酸和氢氧化钠反应生成氯化钠和水,和碳酸钠反应生成氯化钠、水和二氧化碳。
[实验探究]①取少量样品于试管中,滴加酚酞试液,溶液变红色,说明溶液显碱性,说明溶液不是氯化钠溶液;
②向上述试管中,滴加稀盐酸,有气泡产生,说明溶液不是氢氧化钠溶液;
[得出结论]通过以上活动,小明认为瓶中的试剂是碳酸钠溶液,不是碳酸氢钠溶液,理由是室温时,碳酸氢钠的溶解度是9.6g,即使是饱和溶液,溶质质量分数也小于10%;
(2)上层为无色透明的溶液,说明溶液不显碱性,即溶液中不含有碳酸钠、氢氧化钙、氢氧化钠,底部有白色沉淀,说明容器中不含有酸,即溶液中不含有盐酸,则上层溶液中一定含有的溶质是氯化钠,可能含有的溶质是氯化钙。

【题目】NH4C1和Na2SO4的溶解度表及溶解度曲线如下。下列说法错误的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度 S/g | NH4C1 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
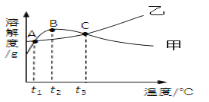
A. t2应介于30℃ ~50℃
B. 10℃ 时,饱和的Na2SO4溶液的溶质质量分数为9.6%
C. 甲、乙饱和溶液从t3降温到t2,溶质的质量分数都变小
D. B点、C点对应的甲的溶液,溶质质量分数大小关系为B>C
【题目】善于在物质间寻找规律,是学好化学的方法之一。下列表格中的三组物质,小星同学对它们作了归纳,请你帮他完成相应内容。(说明:①X为待定物质;②规律不能重复)
物质 | 变化规律 | X的化学式 | 排列规律 |
(1)Na、Al、Cu、Fe、X | 金属活动性:由强到弱 | _________ | Na、X、Al、Fe、Cu. |
(2)FeS、FeO、Fe3O4、X | 物质中铁元素的质量分数:由多到少 | Fe2O3 | ________________ |
(3)NH3、NO、NO2、N2、X | _______________ | N2O3 | NO2、N2O3、NO、N2、NH3 |