题目内容
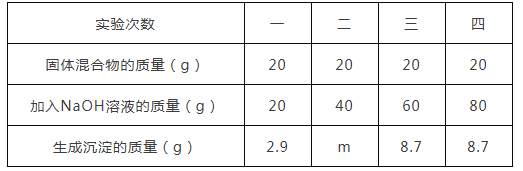
【题目】草木灰是农家肥料,它的有效成分是碳酸钾(K2CO3)。某化学兴趣小组取200g草木灰于烧杯中,不断滴入稀盐酸溶液,当滴入40g稀盐酸时,不再有气泡产生,此时烧杯中的残余混合物质量为235.6g(假设草木灰的其它成分不与酸反应,碳酸钾与盐酸反应的化学方程式为:K2CO3+2HC1=2KCl+CO2↑+H2O)。计算:
(1)反应中产生气体的质量_________
(2)草木灰样品中碳酸钾的质量分数_________(要求写出计算过程)。
【答案】4.4g 6.9%
【解析】
根据质量守恒定律可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳的质量和对应的化学方程式求算草木灰样品中碳酸钾的质量分数。
解:(1)根据质量守恒定律可得,生成的二氧化碳的质量为200g+40g-235.6g=4.4g;
(2)设草木灰样品中碳酸钾的质量分数为x,
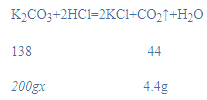
![]()
x=6.9%;
答:(1)反应中产生气体的质量为4.4g;
(2)草木灰样品中碳酸钾的质量分数为6.9%。

【题目】课外小组同学在实验室发现了一瓶标签残缺的无色液体(如图),想通过探究确定其成分,以便重新利用。
(查阅资料)初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。有关四种物质的信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
20oC溶解度/g | 36 | 109 | 21.5 | 9.6 |
水溶液的pH | 7 | 14 | 11 | 9 |
(实验探究)(1)为确定该溶液的成分,小明设计了如下图所示的实验过程:
实验操作 | 实验现象 | 实验结论 |
①取少量样品于试管中, 滴加酚酞试液 | 溶液变红 | 该溶液不可能是______溶液。 |
②向上述试管中,滴加稀盐酸 | 有气泡产生,溶液由红色逐渐变为无色 | 该溶液不可能是_______溶液。 |
(得出结论)通过以上活动,小明认为瓶中的试剂是碳酸钠溶液,不是碳酸氢钠溶液,理由是____________。
(2)小明和小红将实验后的废液倒入同一个烧杯中,小红取少量瓶中的试剂于试管中,向试管中滴加澄清石灰水,充分反应后,与小明所得溶液混合,静置后发现:上层为无色透明的溶液,底部有白色沉淀。则上层溶液中一定含有的溶质是_______(酸碱指示剂除外),可能含有的溶质是___________。
【题目】我国空气质量标准对空气中SO2的浓度级别规定如下表所示(空气中SO2的浓度用单位体积的空气中所含SO2的质量表示)。
浓度级别 | SO2标准(mg/m3) |
一级 | 浓度≤0.15 |
二级 | 0.15<浓度≤0.50 |
三级 | 0.50<浓度≤0.70 |
某中学化学兴趣小组为测定当地空气中SO2的含量。将2m3空气通入一定含量碘(I2)2.54mg的碘水中,经测定I2与SO2恰好完全反应,该反应的化学方程式是: SO2 + I2 + 2H2O =H2SO4 + 2HI 。此空气中SO2的浓度级别是____。