题目内容
【题目】中兴缺“芯”事件震惊国人。芯片是电脑、智能家庭等的核心部件、芯片的主要成分是纯度极高的硅,其运算速率与硅的纯度有关。
(1)硅与金刚石结构相似,则构成硅的粒子是_______(填粒子名称)。已知硅原子结构示意图为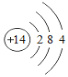 ,下面是四种粒子的结构示意图,其中与硅的化学性质相似的是_______(填序号)。
,下面是四种粒子的结构示意图,其中与硅的化学性质相似的是_______(填序号)。

(2)光伏发电太阳能电池板也需用高纯硅。在日光下高纯硅的作用主要是将光能转化为_______能。
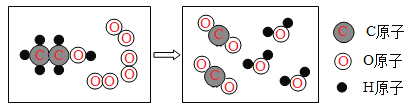
(3)自然界中的硅元素主要以二氧化硅的形式存在,请写出二氧化硅的化学式_______。硅胶是常用的干燥剂,其主要成分可视作二氧化硅(如图),你认为硅胶可作干燥剂的原因可能是____(请写出其中的一种)。

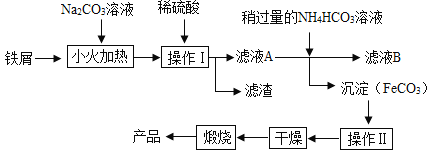
(4)高纯硅的制备以石英砂(主要成分是二氧化硅)为原料,生产过程示意图如下:

①上述四个步骤中属于物理变化的是_______;
②物质M是该生产过程中可循环使用的物质,写出步骤4反应的化学方程式_______,其所属的基本反应类型是_______。
【答案】硅原子(答“原子”也给分) ② 电 SiO2 与水反应(或具有吸水性或具有疏松多孔的结构等合理即可) 步骤3(答“蒸馏”也给分) ![]() 置换反应
置换反应
【解析】
(1)非金属固态单质是由原子直接构成的,所以构成硅的粒子是硅原子,原子的最外层电子数与物质的化学性质有密切的关系,所以与硅的化学性质相似的是②;
(2)光伏发电的太阳能电池板也需用高纯硅,在日光下高纯硅的作用主要是将光能转化为电能;
(3)氧元素在化合物中通常显-2价,二氧化硅的化学式为:SiO2,硅胶可作干燥剂的原因可能是与水反应;
(4)物理变化中没有新物质生成,所以上述四个步骤中属于物理变化的是步骤3,SiHCl3和氢气在高温的条件下生成硅和氯化氢,化学方程式为:![]() ,该反应属于置换反应。
,该反应属于置换反应。

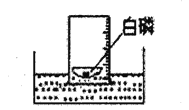
【题目】课外小组同学在实验室发现了一瓶标签残缺的无色液体(如图),想通过探究确定其成分,以便重新利用。
(查阅资料)初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。有关四种物质的信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
20oC溶解度/g | 36 | 109 | 21.5 | 9.6 |
水溶液的pH | 7 | 14 | 11 | 9 |
(实验探究)(1)为确定该溶液的成分,小明设计了如下图所示的实验过程:
实验操作 | 实验现象 | 实验结论 |
①取少量样品于试管中, 滴加酚酞试液 | 溶液变红 | 该溶液不可能是______溶液。 |
②向上述试管中,滴加稀盐酸 | 有气泡产生,溶液由红色逐渐变为无色 | 该溶液不可能是_______溶液。 |
(得出结论)通过以上活动,小明认为瓶中的试剂是碳酸钠溶液,不是碳酸氢钠溶液,理由是____________。
(2)小明和小红将实验后的废液倒入同一个烧杯中,小红取少量瓶中的试剂于试管中,向试管中滴加澄清石灰水,充分反应后,与小明所得溶液混合,静置后发现:上层为无色透明的溶液,底部有白色沉淀。则上层溶液中一定含有的溶质是_______(酸碱指示剂除外),可能含有的溶质是___________。