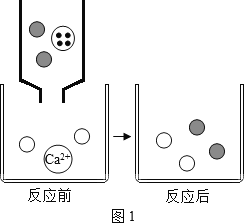
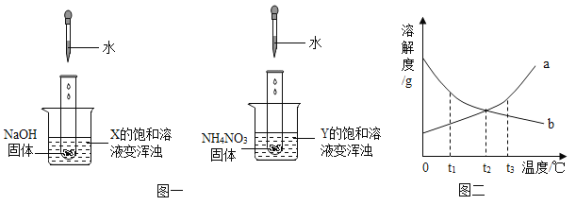
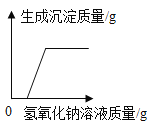
题目内容
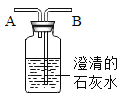
【题目】从事科学实验的重要环节是进行科学实验设计。科学实验的正确步骤:①明确实验目的;②收集有关资料;③设计合理方案;④进行科学实验。请你按照以上四个步骤,完成加热氯酸钾和二氧化锰固体混合物制取氧气的实验设计。根据下图回答问题:
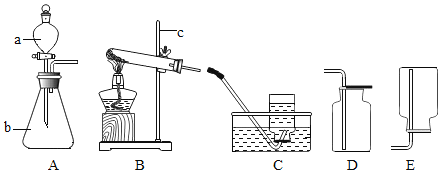
请写出仪器名称:a___ b___ c___
(实验目的)加热氯酸钾和二氧化锰固体混合物制取氧气。
(收集资料) 氯酸钾是白色的固体,二氧化锰是黑色固体。二氧化锰在反应中作催化剂,混合加热后可以产生氧气。
(设计方案)发生装置选用____________(填序号,下同),收集装置选用_____________。该化学反应的化学方程式为________________。如果实验室用A装置来制取氧气,则该化学反应的化学方程式为______________。
(进行实验)能够保证实验成功并收集到一瓶比较纯净的氧气,有许多实验细节需要注意。请任写两点。_______。
【答案】分液漏斗 锥形瓶 铁架台 B C或D 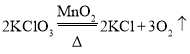
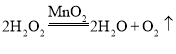 检查装置气密性;有连续均匀气泡冒出时再收集氧气
检查装置气密性;有连续均匀气泡冒出时再收集氧气
【解析】
请写出仪器名称:由图可知a为分液漏斗b为锥形瓶c为铁架台
故填:分液漏斗;锥形瓶;铁架台
[设计方案]
氯酸钾是固体,制氧气需要加热,故发生装置应用加热固体制气体装置,选B;氧气密度比空气大,不易溶于水,故收集装置选C或D;氯酸钾加热生成氯化钾和氧气,化学方程式为;
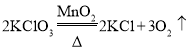
过氧化氢是液体,可加入固体二氧化锰作催化剂制氧气,该反应不需要加热,可用A装置化学方程式为:
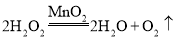
故填:B;C或D;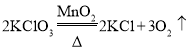 ;
;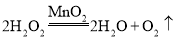
[进行实验]
为保证收集到纯净的氧气,需要保证装置的气密性实验前一定要查气密性,排水法收集气体时,有连续均匀气泡冒出时再收集,因为刚开始排出的是空气,故填:检查装置气密性;有连续均匀气泡冒出时再收集氧气

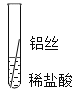
【题目】学习了金属的性质之后,同学们决定用实验对铁、铝、铜三种金属的活动性顺序进行验证.
![]() 实验一
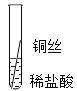
实验一![]() 将粗细相同的铁丝、铝丝、铜丝分别插入相同的稀盐酸中:
将粗细相同的铁丝、铝丝、铜丝分别插入相同的稀盐酸中:
操作 |
|
|
|
片刻后现象 | 有少量气泡 | 无气泡 | 无气泡 |
几分钟后现象 | 有少量气泡 | 有大量气泡 | 无气泡 |
![]() 讨论交流
讨论交流![]() 铝丝在稀盐酸中短时间内无气泡,而一段时间后反应剧烈,是因为 ______
铝丝在稀盐酸中短时间内无气泡,而一段时间后反应剧烈,是因为 ______ ![]() 做金属性质实验前需先将金属进行打磨,目的是 ______
做金属性质实验前需先将金属进行打磨,目的是 ______ ![]() 实验中用到的“相同”盐酸指的是 ______ 相同.
实验中用到的“相同”盐酸指的是 ______ 相同.
![]() 反思评价
反思评价![]() 若不认真分析现象可能导致错误的结论.
若不认真分析现象可能导致错误的结论.
![]() 实验二
实验二![]() 为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中,欲通过实验现象得出金属活动性顺序.
为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中,欲通过实验现象得出金属活动性顺序.
实验过程中能看到:硫酸铝溶液中的铁丝表面 ______ ,硫酸铜溶液中的铁丝表面 ______ ,反应的化学方程式 ______ .
【题目】某同学发现上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,该同学对此进行了探究。请你一起完成下列实验报告。
(1)(提出问题1)该溶液是否变质?
(实验探究1)
实验步骤 | 实验现象 | 解释与结论 |
取少量该溶液放于试管中,滴加足量稀盐酸 | 有____产生 | 说明该溶液已变质,变质的原因是_____(请用化学方程式表示) |
(2)(提出问题2)该溶液变质程度怎样?
(提出猜想)猜想一:已完全变质,该溶液中溶质只含Na2CO3 猜想二:部分变质,该溶液中溶质含有_____
(查阅资料)氯化钡溶液呈中性。
(实验探究2)
实验步骤 | 实验现象 | 结论 |
先取少量该溶液放于试管中,加入过量氯化钡溶液 | 有____生成 | 猜想____成立 |
静置,取上层清液于另一支试管中,加入2-3滴酚酞溶液 | 上层清液变红 |
(3)反思:在(实验探究2)中加入过量的氯化钡溶液的目的是什么?___________________。
(4)拓展:除去部分变质的氢氧化钠溶液中的杂质,方法是___________________(用化学方程式表示)。
(5)提升:为进一步探究氢氧化钠的变质程度,小明称取 18.6 g 氢氧化钠固体样品放入烧杯中,向其中逐滴加入稀盐酸,到不再产生气泡为止,共消耗稀盐酸 100 g,反应后称得烧杯中溶液的质量为 114.2 g。该氢氧化钠的变质程度(即变质的氢氧化钠占变质前的氢氧化钠的质量分数为)__________________。