题目内容
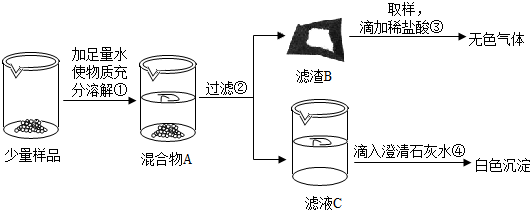
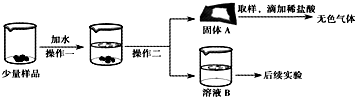 CaO和NaOH固体的混合物,俗名“碱石灰”,实验室常用作干燥剂.碱石灰在空气久置会吸收空气中的水和二氧化碳而变质.某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程.请你参与探究过程:
CaO和NaOH固体的混合物,俗名“碱石灰”,实验室常用作干燥剂.碱石灰在空气久置会吸收空气中的水和二氧化碳而变质.某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程.请你参与探究过程:
(1)在操作一实验过程中,同学们发现向样品中加水时还放出大量的热.据此实验,下列对样品成分分析正确的是______(填序号).
A.一定有NaOH B.一定有Na2CO3
C.一定有CaO D.至少有NaOH、CaO中的一种
(2)为了使样品充分溶解,操作一定还要用到的玻璃仪器是______;操作二的名称是______.
(3)固体A中一定含有______.
(4)溶液B成分的探究.
【查阅资料】①Ca(OH)2、Na2CO3溶于水无明显的温度变化;②Na2CO3溶液呈碱性,能使酚酞试液变红;③CaCl2溶液呈中性.
【猜想】溶液B中溶质可能为:①NaOH②Na2CO3 ③NaOH和Na2CO3④Ca(OH)2和______.
【设计方案并进行实验】甲、乙同学分别设计如下方案并进行探究:
甲同学:取少量溶液B于试管中,滴加足量的稀盐酸,产生大量气泡,则溶液B中的溶质是Na2CO3.
乙同学:取少量溶液B于试管中,滴加几滴酚酞试液,溶液变成红色,则溶液B中的溶质可能含有NaOH.为进一步确认溶液B中溶质的成分,做了如下实验.
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量溶液B于试管中,加入足量CaCl2溶液; ②过滤,在滤液中滴加酚酞试液 | ①______ ②______ | 猜想③正确 |
解:(1)因为氧化钙和氢氧化钠固体溶于水时都放热,因此通过操作一实验对样品成分分析正确的是D;
(2)为了使样品充分溶解,操作一定还要用到的玻璃仪器是玻璃棒;过滤的原理是分离溶于水的固体和不溶于水的固体,所以操作二的名称是过滤;
(3)碳酸钙不溶于水以及能和稀盐酸反应放出二氧化碳气体,固体A中一定含有:碳酸钙(CaCO3);
(4))[猜想]氧化钙和水反应生成氢氧化钙,氢氧化钙还会吸收二氧化碳变成碳酸钙,氢氧化钠会和二氧化碳反应产生碳酸钠,但氢氧化钙和碳酸钠不能共存;所以溶液B中溶质可能为:①NaOH; ②Na2CO3;③NaOH和Na2CO3;④Ca(OH)2和NaOH;
【设计方案并进行实验】氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,CaCl2+Na2CO3=2NaCl+CaCO3↓,加入足量CaCl2溶液这样会除掉全部的碳酸钠,避免干扰NaOH的检验;猜想③正确,说明氢氧化钠是部分变质,故还会看到无色的酚酞试液会变成红色.
故答案为:(1)D (2)玻璃棒 过滤(3)碳酸钙(CaCO3) (4)[猜想]NaOH;[设计方案并进行实验]①有白色沉淀生成 ②溶液由无色变为红色
CaCl2+Na2CO3=2NaCl+CaCO3↓;除尽溶液B中的Na2CO3,避免干扰NaOH的检验(或除去溶液B中的Na2CO3).
分析:(1)根据氧化钙或者是氢氧化钠固体溶于水时放热进行解答;
(2)根据溶解所需的仪器以及过滤的原理进行解答;
(3)根据碳酸钙不溶于水以及能和稀盐酸反应放出二氧化碳气体进行解答;
(4)[猜想]:根据氧化钙和氢氧化钠及其变质的产物进行解答;
【设计方案并进行实验】根据氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,加入足量CaCl2溶液这样会除掉全部的碳酸钠.
点评:熟练掌握碳酸钠、碳酸钙等碳酸盐和氢氧化钠、氧化钙的化学性质,能根据所给的实验或者自己设计实验来验证它们是否变质,并熟练的写出相应的化学方程式.
(2)为了使样品充分溶解,操作一定还要用到的玻璃仪器是玻璃棒;过滤的原理是分离溶于水的固体和不溶于水的固体,所以操作二的名称是过滤;
(3)碳酸钙不溶于水以及能和稀盐酸反应放出二氧化碳气体,固体A中一定含有:碳酸钙(CaCO3);
(4))[猜想]氧化钙和水反应生成氢氧化钙,氢氧化钙还会吸收二氧化碳变成碳酸钙,氢氧化钠会和二氧化碳反应产生碳酸钠,但氢氧化钙和碳酸钠不能共存;所以溶液B中溶质可能为:①NaOH; ②Na2CO3;③NaOH和Na2CO3;④Ca(OH)2和NaOH;
【设计方案并进行实验】氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,CaCl2+Na2CO3=2NaCl+CaCO3↓,加入足量CaCl2溶液这样会除掉全部的碳酸钠,避免干扰NaOH的检验;猜想③正确,说明氢氧化钠是部分变质,故还会看到无色的酚酞试液会变成红色.
故答案为:(1)D (2)玻璃棒 过滤(3)碳酸钙(CaCO3) (4)[猜想]NaOH;[设计方案并进行实验]①有白色沉淀生成 ②溶液由无色变为红色
CaCl2+Na2CO3=2NaCl+CaCO3↓;除尽溶液B中的Na2CO3,避免干扰NaOH的检验(或除去溶液B中的Na2CO3).
分析:(1)根据氧化钙或者是氢氧化钠固体溶于水时放热进行解答;
(2)根据溶解所需的仪器以及过滤的原理进行解答;
(3)根据碳酸钙不溶于水以及能和稀盐酸反应放出二氧化碳气体进行解答;
(4)[猜想]:根据氧化钙和氢氧化钠及其变质的产物进行解答;
【设计方案并进行实验】根据氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,加入足量CaCl2溶液这样会除掉全部的碳酸钠.
点评:熟练掌握碳酸钠、碳酸钙等碳酸盐和氢氧化钠、氧化钙的化学性质,能根据所给的实验或者自己设计实验来验证它们是否变质,并熟练的写出相应的化学方程式.

练习册系列答案
相关题目