题目内容
“碱石灰”是CaO和NaOH固体的混合物,是实验室常用的干燥剂.同学们对一瓶久置的“碱石灰”样品的成分,进行如下实验探究:(1)取“碱石灰”样品,加足量水溶解,过滤,得滤渣和滤液.(2)取滤液少许与试管中,加足量CaCl2溶液,有白色沉淀生成,再加无色酚酞试液,变红.下列关于样品成分的分析正确的是( )
分析:根据取滤液少许与试管中,加足量CaCl2溶液,有白色沉淀生成,说明一定有碳酸钠,既然有碳酸钠所以滤液一定没有氢氧化钙;再加无色酚酞试液,变红,说明溶液呈碱性,那么一定有氢氧化钠进行解答.
解答:解:取滤液少许与试管中,加足量CaCl2溶液,有白色沉淀生成,说明一定有碳酸钠,既然有碳酸钠所以滤液一定没有氢氧化钙;再加无色酚酞试液,变红,说明溶液呈碱性,那么一定有氢氧化钠;取“碱石灰”样品,加足量水溶解,过滤,得滤渣,说明一定生成了碳酸钙,生石灰和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠.
A、NaOH有可能是氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠的,故A错误;
B、加足量CaCl2溶液,有白色沉淀生成,说明一定有碳酸钠,故B正确;
C、氢氧化钠有可能全部生成碳酸钠,所以不一定有,故C错误;
D、碳酸钙有可能是氢氧化钙和碳酸钠反应生成碳酸钙沉淀,也有可能是二氧化碳和和氧化钙或者氢氧化钙反应而生成的碳酸钙,所以不能确定,故D错误.
故选:B.
A、NaOH有可能是氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠的,故A错误;
B、加足量CaCl2溶液,有白色沉淀生成,说明一定有碳酸钠,故B正确;
C、氢氧化钠有可能全部生成碳酸钠,所以不一定有,故C错误;
D、碳酸钙有可能是氢氧化钙和碳酸钠反应生成碳酸钙沉淀,也有可能是二氧化碳和和氧化钙或者氢氧化钙反应而生成的碳酸钙,所以不能确定,故D错误.
故选:B.
点评:熟练掌握碳酸钠、碳酸钙等碳酸盐和氢氧化钠、氧化钙的化学性质,要能根据所给的实验或者自己设计实验来验证它们是否变质,

练习册系列答案
相关题目
某研究性学习小组对“氯碱工业”生产的烧碱样品进行如下探究.
Ⅰ.定性探究
(1)烧碱样品中除含有NaCl外,还可能含有Na2CO3,作出此判断的理由是________ (用化学方程式表示).
(2)实验证明
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁. | 试管外壁发热 | 原因是________ |
| ②向①所得的溶液中逐滴加入________至过量 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体. | 样品中含有的杂质是Na2CO3 |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有的杂质是________ |
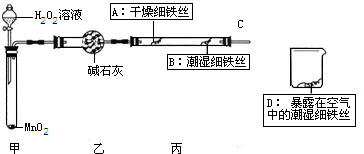
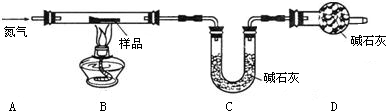
可用下列装置测量烧碱样品中含碳酸钠的质量分数(友情提示:碱石灰成分为CaO和NaOH).请回答下列问题:
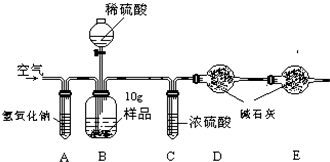
(1)装置A中氢氧化钠溶液的作用是________.
(2)为什么先通一会儿空气后再进行装置B的化学反应,你的理解是________.
(3)写出装置B中化学反应产生气泡的化学方程式________.在滴加稀硫酸时,为什么要滴加到不在产生气泡为止________.
(4)本实验通过碱石灰增重测定CO2的质量,你要称量的装置是________(填D或E或D、E).
某研究性学习小组对“氯碱工业”生产的烧碱样品进行如下探究.
Ⅰ.定性探究
(1)烧碱样品中除含有NaCl外,还可能含有Na2CO3,作出此判断的理由是 (用化学方程式表示).
(2)实验证明
Ⅱ.定量探究:
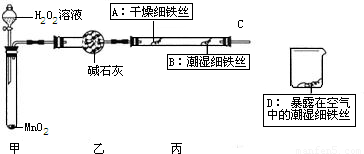
可用下列装置测量烧碱样品中含碳酸钠的质量分数(友情提示:碱石灰成分为CaO和NaOH).请回答下列问题:

(1)装置A中氢氧化钠溶液的作用是 .
(2)为什么先通一会儿空气后再进行装置B的化学反应,你的理解是 .
(3)写出装置B中化学反应产生气泡的化学方程式 .在滴加稀硫酸时,为什么要滴加到不在产生气泡为止 .
(4)本实验通过碱石灰增重测定CO2的质量,你要称量的装置是 (填D或E或D、E).
Ⅰ.定性探究
(1)烧碱样品中除含有NaCl外,还可能含有Na2CO3,作出此判断的理由是 (用化学方程式表示).
(2)实验证明
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁. | 试管外壁发热 | 原因是 |
| ②向①所得的溶液中逐滴加入 至过量 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体. | 样品中含有的杂质是Na2CO3 |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有的杂质是 |
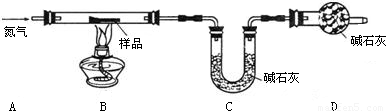
可用下列装置测量烧碱样品中含碳酸钠的质量分数(友情提示:碱石灰成分为CaO和NaOH).请回答下列问题:

(1)装置A中氢氧化钠溶液的作用是 .
(2)为什么先通一会儿空气后再进行装置B的化学反应,你的理解是 .
(3)写出装置B中化学反应产生气泡的化学方程式 .在滴加稀硫酸时,为什么要滴加到不在产生气泡为止 .
(4)本实验通过碱石灰增重测定CO2的质量,你要称量的装置是 (填D或E或D、E).