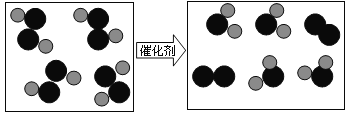
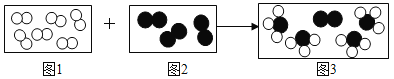
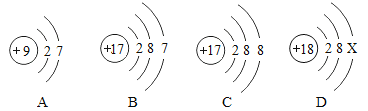
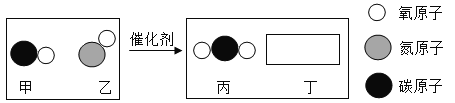
��Ŀ����
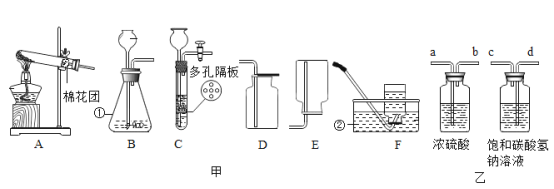
����Ŀ��ijУ��ȤС��ͬѧ�����г����ᡢ��ε�����ʵ��ʱ������ʵ��̨�ϰڷŵ�ҩƷ�У���ͼ������һƿ��Һ���Լ�ƿδ��ƿ���ұ�ǩ�������Ǿ�������ƿ��Һ����ʵ��̽����
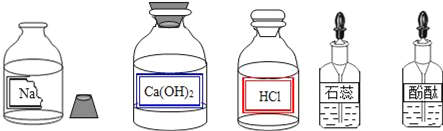
��������⣩��ƿ��Һ��ʲô��Һ��
�������Ϣ���ᡢ��ε�����ʵ�����õ�������Ԫ�ص��������Ȼ��ơ��������ơ�̼����
��������룩��ƿ��Һ�ǣ�
����һ���Ȼ�����Һ�������������������Һ����������̼������Һ��
��ʵ���ƶϣ�
��1��С��ȡ���μ���ɫ��̪��Һ����Һ�ʺ�ɫ���ó����ۣ�����Һ��������__��Һ��������__��
��2��С����ȡ��Ʒ�μ�ϡ������__��������Ӧ�Ļ�ѧ����ʽΪ__��С�յó����ۣ�����Һ��̼������Һ��
��3��С����ΪС�յĽ��۲���ȫ��ȷ��������__��
С��ͬѧ���ۺ�һ����Ϊ����Ҫ��������ʵ�飺
������̽������ȡ��Ʒ���������CaCl2��Һ���۲쵽��__�����������һ�����Ŀ����__�����ú�ȡ�ϲ���Һ�������̪��Һ����Һ�ʺ�ɫ��
��ʵ����ۣ���ƿ��Һ��__��
���𰸡��Ȼ��� �Ȼ�����Һ�����ԣ�����ʹ��̪��Һ��� ���� Na2CO3+2HCl=2NaCl+H2O+CO2�� ¶���ڿ����е�NaOH��Һ������е�CO2��ӦҲ����̼���� ��ɫ���� ��ȫ��ȥ��Һ�е�CO32�����������OH��������ɸ��� ���ʵ�NaOH��Һ
��������
{ʵ���ƶ�}��1���μ���ɫ��̪��Һ����Һ�ʺ�ɫ�������Һ�������Ȼ�����Һ�������Ȼ��ƣ�
�������ƺ�̼������Һ���ʼ��ԣ�����ʹ��̪��Һ���ɫ�����Ȼ�����Һ�����ԣ�����ʹ��̪��Һ��죬���Ը���Һ���������Ȼ�����Һ�������Ȼ�����Һ�����ԣ�����ʹ��̪��Һ��졣
��2����С�յ�ʵ����ۿ�֪������Һ��̼������Һ��̼������ϡ���ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼���۲쵽�������Dz������ݣ��������ݣ�
̼������ϡ���ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼���ʷ�Ӧ�Ļ�ѧ����ʽдΪ��Na2CO3+2HCl=2NaCl+H2O+CO2����
��3����Ϊ���Լ��dz��ڷ����ڿ����У������������ƿ��ܻ�Ϳ����ж�����̼��Ӧ�������ɲ���̼���ƣ�����С����ΪС�յĽ��۲���ȫ��ȷ��������¶���ڿ����е�NaOH��Һ������е�CO2��ӦҲ����̼���ƣ�����¶���ڿ����е�NaOH��Һ������е�CO2��ӦҲ����̼���ơ�
{����̽��}Ҫ֤��ԭ�����������ƣ����ȼӹ����Ȼ�����Һ��Һ����̼��������÷�̪�����������ƵĴ��ڣ�������ȡ�����������CaCl2��Һ���Ȼ�����̼���Ʒ�Ӧ����̼��Ƴ������Ȼ��ƣ��۲쵽�а�ɫ���������������ɫ������
�����Ȼ�����ȫ��̼���Ʒ�Ӧ����̼��Ƴ������Ȼ��ƣ��ܹ���ȫ��ȥ��Һ�е�CO32�����������OH��������ɸ��ţ�������ȫ��ȥ��Һ�е�CO32�����������OH��������ɸ��š�
{ʵ�����}��Ϊ̼�����ת��Ϊ̼��Ƴ������μӷ�̪���ɫ��֤����Һ�����������Ĵ��ڣ����������ƵĴ��ڣ�������ƿ��Һ�DZ��ʵ�NaOH��Һ��������ʵ�NaOH��Һ��

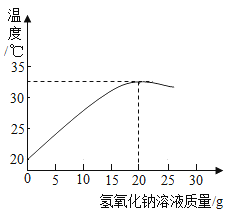
����Ŀ��NH4C1��Na2SO4���ܽ�ȱ����ܽ���������¡�����˵����ȷ���ǣ� ��
�¶�/�� | 10 | 20 | 30 | 40 | 50 | 60 | |
�ܽ��S/g | NH4C1 | 3.33 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
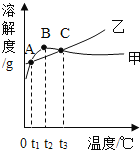
A.��ΪNH4C1���ܽ������
B.�������ʵ��ܽ�Ⱦ����¶����߶�����
C.�ס��ұ�����Һ��t3���µ�t2�����ʵ�������������С
D.�������ļס��ұ�����Һ��t1���µ�t3��Ϊʹ����Һǡ�ñ��ͣ�����ļס��ҹ����������