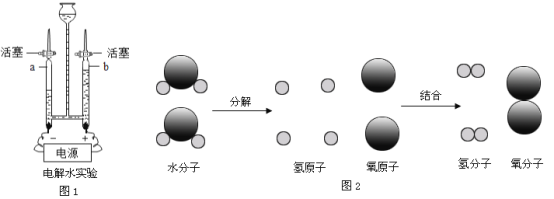
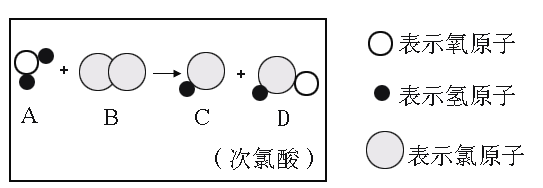
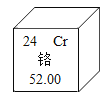
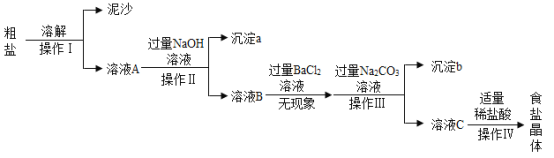
题目内容
【题目】如下图所示,已知A是赤铁矿的主要成分,E的浓溶液稀释时会放出大量的热,G溶液为蓝色,请回答下列问题:
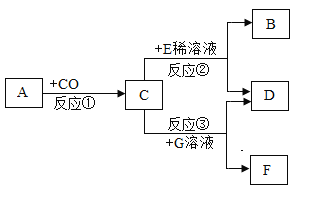
(1)写出D物质的化学式___。在反应①②③中,属于置换反应的是___(填序号)。
(2)工业上常利用反应①的原理来冶炼生铁,反应的化学方程式为___。
(3)A与E的稀溶液发生反应的方程式为____。
【答案】FeSO4 ②③ 
![]()
【解析】
赤铁矿的主要成分是氧化铁,A是氧化铁,浓硫酸稀释时会放出大量的热,E是硫酸,一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,铁和稀硫酸反应生成硫酸亚铁和氢气,C是铁,硫酸铜溶液显蓝色,铁和硫酸铜反应生成硫酸亚铁和铜,G是硫酸铜,D是硫酸亚铁,B是氢气,F是铜。
(1)铁和硫酸铜反应生成硫酸亚铁和铜,G是硫酸铜,D是硫酸亚铁,D物质的化学式为FeSO4。置换反应是由一种单质和一种化合物反应生成另一种单质和另一种化合物,反应①是一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,反应物没有单质,不属于置换反应,反应②是铁和稀硫酸反应生成硫酸亚铁和氢气,反应③是铁和硫酸铜反应生成硫酸亚铁和铜,②③都符合置换反应的特征,都属于置换反应,故在反应①②③中,属于置换反应的是②③。
(2)一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,工业上常利用反应①的原理来冶炼生铁,反应的化学方程式为 。
。
(3)A与E的稀溶液发生反应是氧化铁和稀硫酸反应生成硫酸铁和水,反应的方程式为![]() 。
。

【题目】同学们对“影响金属与盐酸反应剧烈程度的因素”进行了探究。
[提出问题]金属与盐酸反应剧烈程度受哪些因素影响?
[做出猜想] Ⅰ.与盐酸的浓度有关Ⅱ .与____________有关Ⅲ.与金属的种类有关
[进行实验]
实验编号 | 金属 | 盐酸的质量分数% | 温度℃ | 金属丝消失的时间s |
① | 铝丝 | 5 | 20 | 450 |
② | 铝丝 | 8 | 20 | t |
③ | 铝丝 | 10 | 20 | 240 |
④ | 铝丝 | 10 | 30 | 65 |
⑤ | 铁片 | 10 | 30 | 125 |
[解释与结论]
(1)补充猜想:金属与盐酸反应剧烈程度,与____________有关。
(2)铝与盐酸反应的方程式为_________________。
(3)由实验①③可知,猜想1___________。(填“成立”或“不成立”)。在实验②中,铝丝消失的时间(用t表示)的取值范围是_________________。
(4)有同学认为通过实验④⑤并不能证明“猜想与假设Ⅲ”成立,理由是_________________。
【题目】实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小科用相同溶质质量分数的稀盐酸和该混合物反应(所得溶液均为不饱和溶液),四组实验数据记录如下表,请分析计算:)
实验组别 | 一 | 二 | 三 | 四 |
稀盐酸质量/g | 100.0 | 100.0 | 100.0 | 100.0 |
混合物质量/g | 3.0 | 6.0 | 9.0 | 12.0 |
所得溶液质量/g | 101.9 | 103.8 | 105.0 | a |
剩余固体质量/g | 0 | 0 | m | n |
(1)原混合物中碳酸钙与氯化钙的质量比为_____________;
(2)求表中m的值____________ (要求写出完整的过程)。