题目内容
【题目】工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一
系列化工产品,称为氯碱工业。在工业上,制取氯气和烧碱的主要工艺流程如下:

环节Ⅰ:利用海水提取粗盐的过程(如图)。

(1)图中①是 (填“蒸发”或“冷却”)池。
(2)母液为氯化钠的 (填“饱和”或“不饱和”)溶液。
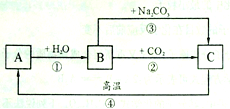
环节Ⅱ:利用工业上粗盐(含MgCl2、CaCl2、Na2SO4等杂质)精制氯化钠(工艺流程如下图)。

(1)X中含有的阳离子是 ;
(2)写出生成沉淀D的一个化学方程式 。
(3)溶液E中加过量稀盐酸的作用是 。
(4)实验所得精盐的质量大于粗盐中NaCl的质量,原因是 。
环节Ⅲ:电解饱和食盐水生产氯气和烧碱并测定烧碱的纯度。
(1)请写出环节Ⅲ生产中发生反应的化学方程式 。
(2)工业烧碱常常含有一定的氯化钠和碳酸钠杂质。为了测定烧碱的含量,小婉同学设计探究方案后进行实验并测得数据如图:

你利用小婉同学测得的数据计算烧碱样品中氢氧化钠的质量分数(请列出计算过程) 。
(3)小强同学认为小婉同学设计的探究方案不够严密,其理由是:
①探究方案中没考虑氢氧化钠的吸水性。
②探究方案中因缺少 (填操作名称),导致测得的氢氧化钠的质量分数偏小。
环节Ⅳ:应用举例
氯气与氢氧化钠溶液反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,工业上用氯气与石灰乳[Ca(OH)2]反应来制取漂白粉,有关反应的化学方程式是 。
【答案】环节Ⅰ:(1)蒸发(2)饱和
环节Ⅱ:(1)Ba2+;(2)Na2CO3+CaCl2=CaCO3↓+2NaCl (或Na2CO3+BaCl2=BaCO3↓+2NaCl) 。
(3)除尽过量的氢氧化钠和碳酸钠 ;(4)除杂过程中会生成一些氯化钠 。
环节Ⅲ:(1)2NaCl+2H2O=2NaOH+H2↑+Cl2↑ 。
(2)算出Na2CO3质量:5.3g(1分)算出NaCl质量:1.17g,NaOH%=67.65%(3)②洗涤
环节Ⅳ:2Cl2+2Ca(OH) 2=CaCl2+Ca(ClO) 2+2H2O 。
【解析】
试题分析:环节Ⅰ:(1)氯化钠的溶解度受温度影响不大,故蒸发结晶,(2)析出晶体后的溶液仍为饱和
环节Ⅱ:(1)加X产生硫酸钡沉淀,故X中一定含Ba2+;依图示:溶液B中含有CaCl2, 写出生成沉淀D的一个化学方程式Na2CO3+CaCl2=CaCO3↓+2NaCl; (3)溶液E中加过量稀盐酸的作用是除尽过量的氢氧化钠和碳酸钠;(4)实验所得精盐的质量大于粗盐中NaCl的质量是除杂过程中会生成一些氯化钠
环节Ⅲ:(1)电解饱和食盐水生产氯气和烧碱即2NaCl+2H2O=2NaOH+H2↑+Cl2↑
解:设Na2CO3质量为X,NaCl质量为Y
Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaCl+AgNO3=AgCl↓+NaNO3
106 44 58.5 143.5
X 0.22g Y 2.87
106/44=X/0.22g 58.5/143.5=Y/2.87g
X=5.3g Y=1.17g
则NaOH的质量为20g-5.3g-1.17g=13.53g;则NaOH%=13.53g/20g×100%=67.65%
②探究方案中因缺少洗涤,沉淀上会有氢氧化钠,导致测得的氢氧化钠的质量分数偏小。
环节Ⅳ:依据提示:2Cl2+2Ca(OH) 2=CaCl2+Ca(ClO) 2+2H2O