题目内容
【题目】A、B、C是三种常见的含钙化合物。它们之间有如图所示的转化关系(部分产物略去)。
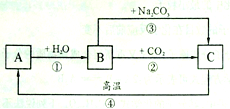
(1)A物质的化学式是 ,B物质的俗称是 ,C物质的名称是 。
(2)向A的块状固体上滴加水,观察到大量的水蒸气产生,该现象说明 。
(3)举出B物质在农业生产中的一种用途: 。
(4)反应②的化学方程式是 。该反应可用来检验二氧化碳气体,实验现象是 。
(5)反应③的基本反应类型是 ,该反应前后元素的化合价 (填“改变”或“不改变”)。
【答案】(1)CaO,熟石灰(消石灰),碳酸钙。(2)CaO与水反应放热。(3)用途:中和酸性土壤。
(4)反应②的化学方程式是Ca(OH)2+CO2=CaCO3↓+H2O。实验现象是生成白色沉淀。
(5)基本反应类型是复分解反应,元素的化合价不改变(填“改变”或“不改变”)。
【解析】
试题分析:根据图中转化关系可知,A能与水反应生成B,B与二氧化碳反应生成C,可以推知A是氧化钙,B是氢氧化钙,C是碳酸钙。(1)A物质的化学式是CaO,B物质的俗称是熟石灰(消石灰),C物质的名称是碳酸钙。(2)向A的块状固体上滴加水,观察到大量的水蒸气产生,该现象说明CaO与水反应放热。(3)熟石灰在农业生产中的一种用途是:中和酸性土壤。(4)反应②的化学方程式是Ca(OH) 2 + CO2 = CaCO3↓+ H2O。该反应可用来检验二氧化碳气体,将二氧化碳气体通入澄清石灰水中,石灰水变浑浊,即生成白色沉淀。(5)反应③是Ca(OH) 2 + Na2CO3 = CaCO3↓+ 2NaOH,该反应属于复分解反应,反应前后元素的化合价没有改变。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目