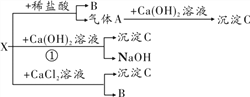
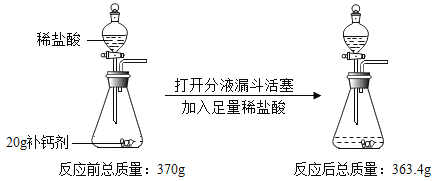
题目内容
【题目】(2018遵义改编)盐酸、硫酸和硝酸都是重要的酸,下列是探究酸性质的实验。

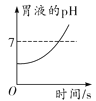
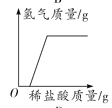
(1)能区分稀盐酸和稀硫酸的是_____(选填“实验一”或“实验二”),此实验中观察到的现象是_____。
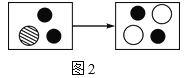
(2)如图2是装有稀硫酸的试管中加入硝酸钡溶液前后主要离子种类及个数比变化示意图。则“![]() ”代表的离子是_____(填离子符号)。
”代表的离子是_____(填离子符号)。
(3)实验三稀盐酸中无明显现象;稀硝酸中的现象为铜片逐渐溶解,溶液变蓝,并有气泡产生,反应为3Cu+8HNO3=3Cu(NO3)2+2X↑+4H2O,则X的化学式为_____。
(4)实验室利用氢气还原氧化铜后,试管内壁上常附着一些铜,清洗方法是_____。
【答案】实验二 稀盐酸中无现象,稀硫酸中产生白色沉淀 H+ NO 先加入适量的稀硝酸充分反应,再用水冲洗(或加热至红色固体全部变黑,冷却后加入适量稀盐酸或稀硫酸充分反应后用水清洗,合理即可)
【解析】
(1)盐酸和硫酸都属于酸,都能使紫色石蕊溶液变红,因而不能用实验一鉴别二者;实验二中能产生白色沉淀的是稀硫酸,没有白色沉淀产生的是稀盐酸,实验二可区分二者。(2)向稀硫酸中滴加硝酸钡溶液,反应前溶液中的离子是H+、SO![]() ,恰好完全反应后的溶液中的离子是H+和NO
,恰好完全反应后的溶液中的离子是H+和NO![]() ,因而图中的“●”表示的离子是H+。(3)根据化学方程式可知,反应前有3个铜原子、8个氢原子、8个氮原子、24个氧原子,反应后已知生成物中有3个铜原子、8个氢原子、6个氮原子、22个氧原子,根据化学反应前后原子种类、数目不变对比分析可知,2X中有2个氮原子、2个氧原子,因此X的化学式为NO。(4)由(3)的信息可知,铜能与稀硝酸反应,因而实验室用氢气还原氧化铜之后试管内壁附着的铜可先加入适量的稀硝酸充分反应,再用水冲洗,也可以加热至红色固体全部变黑,冷却后加入适量稀盐酸或稀硫酸充分反应后用水清洗。
,因而图中的“●”表示的离子是H+。(3)根据化学方程式可知,反应前有3个铜原子、8个氢原子、8个氮原子、24个氧原子,反应后已知生成物中有3个铜原子、8个氢原子、6个氮原子、22个氧原子,根据化学反应前后原子种类、数目不变对比分析可知,2X中有2个氮原子、2个氧原子,因此X的化学式为NO。(4)由(3)的信息可知,铜能与稀硝酸反应,因而实验室用氢气还原氧化铜之后试管内壁附着的铜可先加入适量的稀硝酸充分反应,再用水冲洗,也可以加热至红色固体全部变黑,冷却后加入适量稀盐酸或稀硫酸充分反应后用水清洗。