题目内容
【题目】如图所示的四个图像,下列有关叙述正确的是( )
A.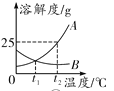 将t2 ℃的A和B饱和溶液分别降温到t1 ℃后,两溶液的溶质质量分数相同
将t2 ℃的A和B饱和溶液分别降温到t1 ℃后,两溶液的溶质质量分数相同
B. 表示高温煅烧一定质量碳酸钙的反应,纵坐标Y可表示固体中钙元素的质量分数
表示高温煅烧一定质量碳酸钙的反应,纵坐标Y可表示固体中钙元素的质量分数
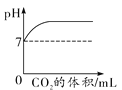
C.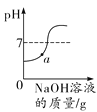 表示向稀盐酸中加入氢氧化钠溶液的反应,a点溶液中所含的溶质是HCl
表示向稀盐酸中加入氢氧化钠溶液的反应,a点溶液中所含的溶质是HCl
D.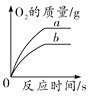 表示氯酸钾制取氧气,a是加入催化剂的反应,b表示没加催化剂的反应
表示氯酸钾制取氧气,a是加入催化剂的反应,b表示没加催化剂的反应
【答案】B
【解析】
B物质的溶解度随温度的降低而增大,应该按照t2 ℃时的溶解度进行计算,所以将A和B的饱和溶液分别降温到t1 ℃后,A的溶质质量分数为t1 ℃时A饱和溶液的溶质质量分数,B的溶质质量分数为t2 ℃时B饱和溶液的溶质质量分数,两溶液的溶质质量分数不相同,A错误;将一定质量的碳酸钙高温煅烧,加热到一定温度碳酸钙才能分解,碳酸钙高温分解生成氧化钙和二氧化碳,反应后二氧化碳逸出,钙元素质量不变,剩余固体中钙元素质量分数增大,至完全反应不再发生改变,故纵坐标Y可表示固体中钙元素的质量分数,B正确;氢氧化钠和盐酸反应生成氯化钠和水,所以向稀盐酸中加入氢氧化钠溶液的反应,a点溶液的pH<7,溶液中所含的溶质是氯化氢和氯化钠,C错误;催化剂只会影响氯酸钾分解生成氧气的速率,不会影响生成氧气的质量,D错误。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案【题目】高锰酸钾在生产、生活中有广泛的应用。实验小组同学查阅资料得知,草酸(H2C2O4)可使滴有硫酸的高锰酸钾溶液褪色,但不同条件下褪色时间不同,即反应的速率不同。小组同学进行了如下探究。
(提出问题)影响该反应反应速率的因素有哪些?
(作出猜想)影响该反应反应速率的因素有温度、催化剂、硫酸的浓度等。
(查阅资料)硫酸锰(MnSO4)可作该反应的催化剂。
(进行实验)取A、B、C、D 4支试管,每支试管中分别加入4mL 0.08% 的KMnO4 溶液、0.4 mL 的硫酸、1mL 0.09% 的 H2C2O4 溶液。

(实验记录)
序号 | 所滴硫酸浓度 | 温度 | 催化剂 | 高锰酸钾完全褪色时间 |
A | 98% | 室温 | 无 | 72s |
B | 65% | 室温 | 无 | 129s |
C | 65% | 50℃ | 无 | 16s |
D | 65% | 室温 | MnSO4 | 112s |
(解释与结论)
(1)草酸使高锰酸钾溶液褪色反应的化学方程式如下,请在横线上补全方程式。
2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2MnSO4 + 10_______+ 8H2O
(2)4支试管中作为对照实验的是_______(填序号,下同)。
(3)设计实验A和B的目的是 ______________________________。
(4)对比实验B和C可得出的结论是_____________________________。
(5)探究催化剂对该反应反应速率影响的实验是____________________________。
(反思与交流)
(6)影响该反应反应速率的因素除温度、催化剂、硫酸的浓度外,还可能有_______。
【题目】不同温度时![]() ,
,![]() 的溶解度如下表,图是它们的溶解度曲线。请回答下列问题:
的溶解度如下表,图是它们的溶解度曲线。请回答下列问题:
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度/g |
| 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| 13.3 | 31.6 | 63.9 | 110 | 169 | |
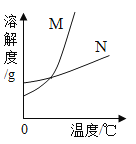
(1)图中,![]() 的溶解度曲线是_____(选填“M”或“N”).
的溶解度曲线是_____(选填“M”或“N”).
(2)20℃时,将![]() 加入100g水中,充分溶解后,溶液中氯化钠的质量分数是_____(选填序号)
加入100g水中,充分溶解后,溶液中氯化钠的质量分数是_____(选填序号)
A 40% B 28.6% C 36% D 26.5%
(3)25℃时,将![]() 、
、![]() 各30g分别加入100g水中,充分溶解后,所得溶液的溶质质量分数的关系是:
各30g分别加入100g水中,充分溶解后,所得溶液的溶质质量分数的关系是:![]() _____(选填“>”、“<”或“=”)
_____(选填“>”、“<”或“=”)![]() 。
。
(4)80℃时,分别用100g水,配制成![]() 、
、![]() 的饱和溶液,然后都降温至20℃,析出晶体的质量关系是:
的饱和溶液,然后都降温至20℃,析出晶体的质量关系是:![]() _____(选填“>”、“<”或“=”)
_____(选填“>”、“<”或“=”)![]() 。
。
(5)现用氢氧化钠固体配制100g10%的氢氧化钠溶液。需量取_____mL(水的密度为![]() )水,应选择的量筒的规格是_____mL(选填“10”、“100”或“250”)。
)水,应选择的量筒的规格是_____mL(选填“10”、“100”或“250”)。