题目内容
现有一瓶久置的未开启的NaOH,通过下列问题和实验对该瓶NaOH是否变质进行研究.
(1)写出NaOH固体变质的化学方程式
(2)能否用酚酞试液来检验NaOH是否变质?请说明理由.
(3)从瓶中取少量固体于试管中,滴加足量的稀HCl,有气泡产生,该现象能否说明NaOH已经变质?请用方程式说明理由.
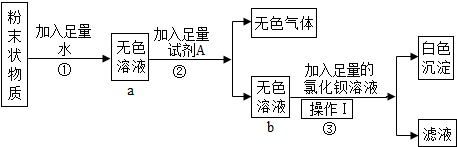
(4)为证明变质的固体中仍然存在NaOH,某同学按如下操作进行实验:
①取少量固体溶于水,向其中滴加足量的CaCl2溶液,现象为 ,反应的化学方程式为 .
②取①所得的溶液于试管中,向其中滴加少量的 ,现象为 .其结论是 .
(1)写出NaOH固体变质的化学方程式
(2)能否用酚酞试液来检验NaOH是否变质?请说明理由.
(3)从瓶中取少量固体于试管中,滴加足量的稀HCl,有气泡产生,该现象能否说明NaOH已经变质?请用方程式说明理由.
(4)为证明变质的固体中仍然存在NaOH,某同学按如下操作进行实验:
①取少量固体溶于水,向其中滴加足量的CaCl2溶液,现象为
②取①所得的溶液于试管中,向其中滴加少量的
考点:碱的化学性质,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:常见的碱 碱的通性
分析:(1)根据NaOH的变质原因是吸收了空气中的CO2生成了Na2CO3进行分析;
(2)如果使用酚酞试液,因为碳酸钠溶液呈碱性,所以反应前后的溶液中加酚酞都变红无法分辨;
(3)根据碳酸盐和盐酸反应会生成二氧化碳气体进行分析;
(4)根据CaCl2+Na2CO3═CaCO3↓+2NaCl,所以加入足量的CaCl2溶液可使溶液中的CO32-全部转化成沉淀,那么再利用酚酞试液鉴别氢氧化钠时不会形成干扰等知识进行分析.
(2)如果使用酚酞试液,因为碳酸钠溶液呈碱性,所以反应前后的溶液中加酚酞都变红无法分辨;
(3)根据碳酸盐和盐酸反应会生成二氧化碳气体进行分析;
(4)根据CaCl2+Na2CO3═CaCO3↓+2NaCl,所以加入足量的CaCl2溶液可使溶液中的CO32-全部转化成沉淀,那么再利用酚酞试液鉴别氢氧化钠时不会形成干扰等知识进行分析.
解答:解:(1)NaOH的变质原因是吸收了空气中的CO2生成了Na2CO3,化学方程式为:2NaOH+CO2=Na2CO3+H2O;
(2)因为碳酸钠是强碱弱酸盐也呈碱性,溶液中加酚酞都变红,所以无法分辨;
(3)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(4)①取少量固体溶于水,向其中加入足量的CaCl2溶液,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,现象为有白色沉淀生成,反应的化学方程式为:CaCl2+Na2CO3═CaCO3↓+2NaCl;
②取①所得的溶液于试管中,向其中滴加少量的酚酞试液,现象为:溶液变红,所以得出的结论是:固体中仍然含有氢氧化钠.
故答案为:(1)2NaOH+CO2=Na2CO3+H2O;
(2)碳酸钠溶液显碱性,也能使无色酚酞变红色;
(3)Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(4)①有白色沉淀生成,CaCl2+Na2CO3═CaCO3↓+2NaCl;
②溶液变红,固体中仍然含有氢氧化钠.
(2)因为碳酸钠是强碱弱酸盐也呈碱性,溶液中加酚酞都变红,所以无法分辨;
(3)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(4)①取少量固体溶于水,向其中加入足量的CaCl2溶液,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,现象为有白色沉淀生成,反应的化学方程式为:CaCl2+Na2CO3═CaCO3↓+2NaCl;
②取①所得的溶液于试管中,向其中滴加少量的酚酞试液,现象为:溶液变红,所以得出的结论是:固体中仍然含有氢氧化钠.
故答案为:(1)2NaOH+CO2=Na2CO3+H2O;
(2)碳酸钠溶液显碱性,也能使无色酚酞变红色;
(3)Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(4)①有白色沉淀生成,CaCl2+Na2CO3═CaCO3↓+2NaCl;
②溶液变红,固体中仍然含有氢氧化钠.
点评:在解此类题时,首先分析题中的反应原理,然后将题中信息和课本知识的联系,看清每步操作的目的或反应实质即可较快解答.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
聚乳酸是一种新型可生物降解的高分子材料,可用于制造可降解塑料.聚乳酸由乳酸(CH3CHOHCOOH)在催化剂作用下聚合而成.下列说法正确的是( )
| A、乳酸属于无机化合物 |
| B、乳酸由碳原子、氢原子、氧原子构成 |
| C、乳酸中氧元素的质量分数最大 |
| D、使用聚乳酸制造塑料会造成“白色污染” |
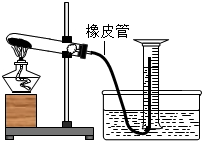 如图所示,为了测定实验室中高锰酸钾样品的纯度(假设杂质不参加反应),小衢称取4.0g该样品于试管中加热,用量筒收集生成的气体,高锰酸钾完全分解后,移去酒精灯,待装置冷却到室温后,得到0.23L氧气(常温下氧气的密度约为1.4g/L).
如图所示,为了测定实验室中高锰酸钾样品的纯度(假设杂质不参加反应),小衢称取4.0g该样品于试管中加热,用量筒收集生成的气体,高锰酸钾完全分解后,移去酒精灯,待装置冷却到室温后,得到0.23L氧气(常温下氧气的密度约为1.4g/L). 如图是测定空气中氧气含量的实验图,请回答:
如图是测定空气中氧气含量的实验图,请回答: