题目内容
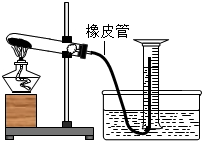 如图所示,为了测定实验室中高锰酸钾样品的纯度(假设杂质不参加反应),小衢称取4.0g该样品于试管中加热,用量筒收集生成的气体,高锰酸钾完全分解后,移去酒精灯,待装置冷却到室温后,得到0.23L氧气(常温下氧气的密度约为1.4g/L).
如图所示,为了测定实验室中高锰酸钾样品的纯度(假设杂质不参加反应),小衢称取4.0g该样品于试管中加热,用量筒收集生成的气体,高锰酸钾完全分解后,移去酒精灯,待装置冷却到室温后,得到0.23L氧气(常温下氧气的密度约为1.4g/L).请回答下列问题:
(1)收集到氧气的质量约
(2)该样品中高锰酸钾的质量分数是多少?
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:(1)根据质量=密度×体积解答;
(2)根据氧气的质量可以计算高锰酸钾的质量分数解答.
(2)根据氧气的质量可以计算高锰酸钾的质量分数解答.
解答:解:
(1)收集到氧气的质量约为:1.4g/L×0.23L=0.32g.
(2)设该样品中高锰酸钾的质量为x
2KMnO4
K2MnO4+MnO2 +O2↑
316 32
x 0.32g
=
x=3.16g
样品中高锰酸钾的质量分数是:
×100%=79%;
答案:
(1)0.32
(2)样品中高锰酸钾的质量分数是79%
(1)收集到氧气的质量约为:1.4g/L×0.23L=0.32g.
(2)设该样品中高锰酸钾的质量为x
2KMnO4
| ||
316 32
x 0.32g
| 316 |
| 32 |
| x |
| 0.32g |
x=3.16g
样品中高锰酸钾的质量分数是:
| 3.16g |
| 4g |
答案:
(1)0.32
(2)样品中高锰酸钾的质量分数是79%
点评:本题主要考查学生对物质质量守恒定律的认识以及利用化学方程式和质量分数公式进行计算的能力.

练习册系列答案
相关题目

 根据实验要求完成下列各题:
根据实验要求完成下列各题: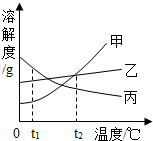 如图,是甲、乙、丙三种物质的溶解度曲线.据图回答:
如图,是甲、乙、丙三种物质的溶解度曲线.据图回答: