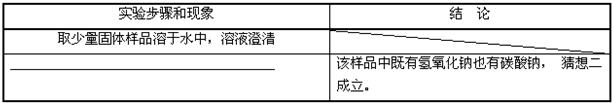
��Ŀ����
ij��ѧ��ȤС���û�ѧ�����ⶨһ�ָ���Ʒ�����ĺ�����ͬѧ�dz�ȡ��5.7g����Ʒ��Ͷ��װ��10.0gϡ���ᣨ���������ձ����ձ�����ҲΪ10.0g���У��ڻ�ѧ��Ӧ�����ж��ձ���������Һ�Ͳ�����壩�������Ĵγ�������¼���±���
��1����Ӧ�в�������
��2����ͬѧ��������տ�ʹ���е�̿��ΪCO2�ӷ��������պ����Ʒ��������ᣮ�������ǽ�һ�����ĸ���Ʒ���պ����������������˺࣮ܶԭ����
��3���ֵ����ͷ�Ϊ���ַ�Ϊ��̼�֡���̼�֡���̼�֣�����������ձ��еĺ�ɫ����ȫ����̿�������ָ����ڣ�д��������̣�
| ��Ӧʱ�� | t0 | t1 | t2 | t3 |
| �ձ���ҩƷ����/g | 25.7 | 25.6 | 25.5 | 25.5 |
0.2
0.2
�ˣ����ָ���Ʒ�����ĺ����Ƕ��٣�����ȷ��0.1%����2����ͬѧ��������տ�ʹ���е�̿��ΪCO2�ӷ��������պ����Ʒ��������ᣮ�������ǽ�һ�����ĸ���Ʒ���պ����������������˺࣮ܶԭ����
��Ϊ̼���ٵ�������ԶС����ת��Ϊ���������ӵ�����
��Ϊ̼���ٵ�������ԶС����ת��Ϊ���������ӵ�����
��3���ֵ����ͷ�Ϊ���ַ�Ϊ��̼�֡���̼�֡���̼�֣�����������ձ��еĺ�ɫ����ȫ����̿�������ָ����ڣ�д��������̣�
��������1���������ݱ����������γƵ������͵��ĴγƵ�������ȣ�������˵���ڵ����γ���ʱ����ȫ��Ӧ����ʱ���Ƶ�����Ϊ25.5g���뷴Ӧǰ��������=5.7g+10g+10g=25.7g��ȣ�����0.2g�����ڷ�Ӧ��ֻ�ų�������������������������Ϊ0.2g������Ϊ����̼�Ļ�������̼�������ᷴӦ��������������Ϊ�������ᷴӦ��������
��2����������ʱ���ᷢ��������Ӧ��������������������
��3�����ݡ���1���е����ָ���Ʒ�����ĺ�������������ָ���Ʒ�к�̼����������֪�����Ϳ�֪����������һ�ָ֣�
��2����������ʱ���ᷢ��������Ӧ��������������������
��3�����ݡ���1���е����ָ���Ʒ�����ĺ�������������ָ���Ʒ�к�̼����������֪�����Ϳ�֪����������һ�ָ֣�
����⣺��1�����������غ㣬��Ӧǰ�������Ϊ����������������������������=5.7g+10g+10g-25.5g=0.2g��
��5.7g����Ʒ�к�������Ϊx����
Fe+2HCl=FeCl2+H2��
56 2
x 0.2g
=
��ã�x=5.6g
�����ָ���Ʒ������
��100%��98.2%��
�����ָ���Ʒ�����ĺ�����98.2%��
��2������ʱ������������Ӧ���������������ʹʣ������������ӣ�̼��������Ӧ�ų�������̼��ʹʣ������������٣��������к��н϶������ֻ��������̼����ˣ���һ�����ĸ���Ʒ���պ��������������������ࣻ
��2���ֵ����ͷ�Ϊ����̼������C%��0.03%��0.3%Ϊ��̼�֣�0.3%��0.6%Ϊ��̼�֣�0.6%��2%Ϊ��̼�֣����ָ���Ʒ�к�̼��Ϊ��1-98.2%=1.8%�������ָ����ڸ�̼�֣�
�ʴ��ǣ���1��0.2�����ָ���Ʒ�����ĺ�����98.2%����2����Ϊ̼���ٵ�������ԶС����ת��Ϊ���������ӵ���������3����̼�֣�
��5.7g����Ʒ�к�������Ϊx����
Fe+2HCl=FeCl2+H2��
56 2
x 0.2g
| 56 |
| 2 |
| x |
| 0.2g |
�����ָ���Ʒ������
| 5.6g |
| 5.7g |
�����ָ���Ʒ�����ĺ�����98.2%��
��2������ʱ������������Ӧ���������������ʹʣ������������ӣ�̼��������Ӧ�ų�������̼��ʹʣ������������٣��������к��н϶������ֻ��������̼����ˣ���һ�����ĸ���Ʒ���պ��������������������ࣻ
��2���ֵ����ͷ�Ϊ����̼������C%��0.03%��0.3%Ϊ��̼�֣�0.3%��0.6%Ϊ��̼�֣�0.6%��2%Ϊ��̼�֣����ָ���Ʒ�к�̼��Ϊ��1-98.2%=1.8%�������ָ����ڸ�̼�֣�
�ʴ��ǣ���1��0.2�����ָ���Ʒ�����ĺ�����98.2%����2����Ϊ̼���ٵ�������ԶС����ת��Ϊ���������ӵ���������3����̼�֣�
���������������غ㶨�ɣ���ʵ���¼�����ݷ����ó���Ӧ�ų�������������Ϊ�����Ļ��������ֳ�����֪ʶ���������������

��ϰ��ϵ�д�
 �����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
�����Ŀ
ij��ѧ��ȤС���û�ѧ�����ⶨһ�ָ���Ʒ�����ĺ�����ͬѧ�dz�ȡ��5.7g����Ʒ��Ͷ��װ��10.0gϡ���ᣨ���������ձ����ձ�����ҲΪ10.0g���У��ڻ�ѧ��Ӧ�����ж��ձ���������Һ�Ͳ�����壩�������Ĵγ�������¼���±���
��Ӧ�в������� �ˣ����ָ���Ʒ�����ĺ����Ƕ��٣�����ȷ��0.1%��
| ��Ӧʱ�� | t0 | t1 | t2 | t3 |
| �ձ���ҩƷ����/g | 25.7 | 25.6 | 25.5 | 25.5 |
ij��ѧ��ȤС���û�ѧ�����ⶨһ�ָ���Ʒ�����ĺ�����ͬѧ�dz�ȡ��11.3 g����Ʒ��Ͷ��װ��20gϡ���ᣨ���������ձ����ձ�����Ϊ15g���У��ڻ�ѧ��Ӧ�Ĺ����ж��ձ���������Һ�Ͳ�����壩�������Ĵγ�������¼���±���
��1����Ӧ�в������� g�����ָ���Ʒ�����ĺ����Ƕ��٣�����ȷ��0.1%��
��2���ֵ����Ϳɷ�Ϊ����̼����C%��0.03%��0.3%Ϊ��̼�֣�0.3%��0.6%Ϊ��̼�֣�0.6%��2%Ϊ��̼�֣�����������ձ��еĺ�ɫ����ȫ����̼�������ָ����� ��
��3����ͬѧ��������տ�ʹ���е�̼��ΪCO2���ų������պ����Ʒ��������ᣮ�������ǽ�һ�����ĸ���Ʒ���պ����������������˺࣮ܶԭ���� ��
| ��Ӧʱ�� | t0 | t1 | t2 | t3 |
| �ձ���ҩƷ������g�� | 46.3 | 46.1 | 45.9 | 45.9 |
��2���ֵ����Ϳɷ�Ϊ����̼����C%��0.03%��0.3%Ϊ��̼�֣�0.3%��0.6%Ϊ��̼�֣�0.6%��2%Ϊ��̼�֣�����������ձ��еĺ�ɫ����ȫ����̼�������ָ�����
��3����ͬѧ��������տ�ʹ���е�̼��ΪCO2���ų������պ����Ʒ��������ᣮ�������ǽ�һ�����ĸ���Ʒ���պ����������������˺࣮ܶԭ����
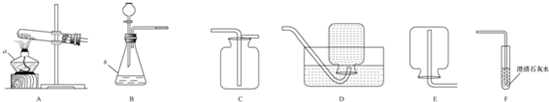
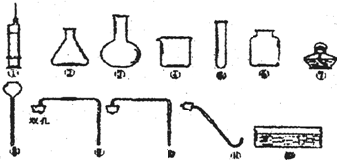 ��Уij��ѧ��ȤС��ͬѧѧϰ��ѧ�����Ըߣ�ƽʱϲ���ռ���ѧ��Ʒ�������������Լ���ʵ���ң���ʵ�����в���������ͼ��
��Уij��ѧ��ȤС��ͬѧѧϰ��ѧ�����Ըߣ�ƽʱϲ���ռ���ѧ��Ʒ�������������Լ���ʵ���ң���ʵ�����в���������ͼ��