题目内容
1909年,化学家哈伯用氮气和氢气在高温高压条件下首次合成了氨气,反应原理为N2+3H2
2NH3.氨气具有可燃性,燃烧时发热量高.近年,科学家发现用催化剂在常温下就能合成氨气,使其有望成为替代氢能的新一代能源
(1)若用下面三幅模型图表示合成氨气的过程.
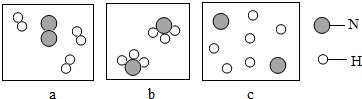 !
!
①则从反应开始到完成的排列顺序为(用字母表示) .
②分析图中微观过程,你能总结出的一条结论是 .
(2)氨气燃烧时可能生成氧化物而污染环境,但在一定条件下,氨气燃烧却没有任何污染,该反应原理是4NH3+3O2
2N2+6X,其中X的化学式是 ,请写出X物质具有的一条物理性质 .
(3)如果氨气不慎泄露,在关闭阀门和防止明火的前提下,喷洒大量水雾即可.由此可知氨气可能具有的一条性质是 .
| ||
(1)若用下面三幅模型图表示合成氨气的过程.
 !
!①则从反应开始到完成的排列顺序为(用字母表示)
②分析图中微观过程,你能总结出的一条结论是
(2)氨气燃烧时可能生成氧化物而污染环境,但在一定条件下,氨气燃烧却没有任何污染,该反应原理是4NH3+3O2
| ||
(3)如果氨气不慎泄露,在关闭阀门和防止明火的前提下,喷洒大量水雾即可.由此可知氨气可能具有的一条性质是
考点:微粒观点及模型图的应用,化学性质与物理性质的差别及应用,质量守恒定律及其应用
专题:化学反应模拟图型
分析:(1)①根据化学变化的实质进行排序;
②根据微粒的变化分析化学反应的实质;
(2)根据质量守恒定律分析X,再回答有关的物理性质;
(3)根据泄露的氨气可喷洒大量水雾分析性质.
②根据微粒的变化分析化学反应的实质;
(2)根据质量守恒定律分析X,再回答有关的物理性质;
(3)根据泄露的氨气可喷洒大量水雾分析性质.
解答:解:(1)①合成氨的微观过程是氢气分子、氮气分子分解成单个的原子,然后氮原子和氢原子再组合成氨气分子,观察图示,顺序为:ACB;
②由上述微粒的变化可知,化学反应的实质是:分子的破裂,原子的重新组合.
(2)由“4NH3+3O2
2N2+6X反应中”,根据质量守恒定律的元素守恒,则反应前后元素种类不变,原子的个数相等,反应前:N原子4个、H原子12个、O原子6个,反应后:N原子4个.则6X中含有H原子12个、O原子6个,故可知X的化学式为H2O;水是无色的液体.
(3)如果氨气不慎泄露,喷洒大量水雾即可吸收氨气,说明氨气极易溶于水.
故答案为:(1)①ACB,②化学反应的实质是:分子的破裂,原子的重新组合;(2)H2O,无色的液体(3)极易溶于水.
②由上述微粒的变化可知,化学反应的实质是:分子的破裂,原子的重新组合.
(2)由“4NH3+3O2
| ||
(3)如果氨气不慎泄露,喷洒大量水雾即可吸收氨气,说明氨气极易溶于水.
故答案为:(1)①ACB,②化学反应的实质是:分子的破裂,原子的重新组合;(2)H2O,无色的液体(3)极易溶于水.
点评:正确解读题目给出的信息是解决信息性题目的关键,要善于从信息中捕捉最有效的信息用来处理问题.

练习册系列答案
相关题目
四位同学正在讨论某一个化学方程式表示的意义,他们所描述的化学方程式是( )
甲:反应在点燃的条件下进行 乙:各物质的分子个数比为2:1:2
丙:是化合反应 丁:各物质的质量比为1:8:9.
甲:反应在点燃的条件下进行 乙:各物质的分子个数比为2:1:2
丙:是化合反应 丁:各物质的质量比为1:8:9.
A、CH4+2O2
| ||||
B、S+O2
| ||||
C、2CO+O2
| ||||
D、2H2+O2
|
 电动自行车以轻便、省力、操作简单、节能的优势正日益受到城镇居民的青睐.
电动自行车以轻便、省力、操作简单、节能的优势正日益受到城镇居民的青睐.