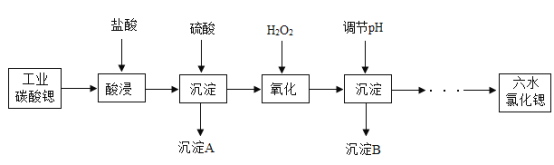
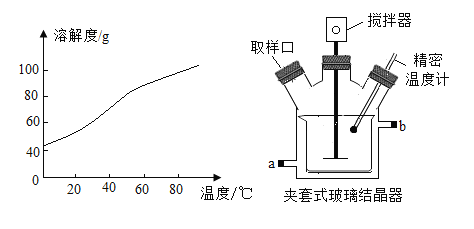
题目内容
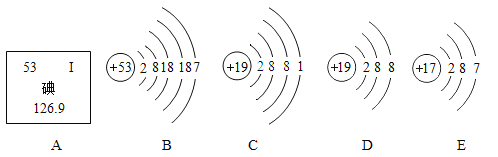
【题目】在一个密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
物质 | X | Y | Z | Q |
反应前质量/g | 4 | 10 | 1 | 21 |
反应后质量/g | 0 | 12 | 15 | 待测 |
已知X的对分子质量为n,Q的相对分子质量为2n。下列推理正确的是( )
A.反应后Q的质量为12g
B.该化学方程式中X与Q的化学计量数之比为2:3
C.反应后生成15gZ
D.反应中Y与Q发生改变的质量比为1:1
【答案】B
【解析】
根据质量守恒定律,反应后Q的质量为4g+10g+1g+21g-0g-12g-15g=9g,Y、Z物质反应后质量增加,是生成物;X、Q物质反应后质量减少,是反应物。
A、反应后Q的质量为9g,故A错误;
B、化学方程式中X与Q的化学计量数之比为:![]() ,故B正确;
,故B正确;
C、反应后生成Z的质量为:15g-1g=14g,故C错误;
D、反应中Y与Q发生改变的质量之比为:(12g-10g):(21g-9g)=1:6,故D错误。
故选B。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动,请你和他们一起完成以下实验探究。
(提出问题)将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中,实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
(查阅资料) CaCl2溶液显中性
(猜想与假设)针对疑问,甲组同学猜想如下:
猜想I :只有CaCl2;
猜想II:有______________________。
猜想Ⅲ:有CaCl2和Ca(OH)2;
猜想IV:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想IV不合理,其理由是______________________。(用化学方程式解释)
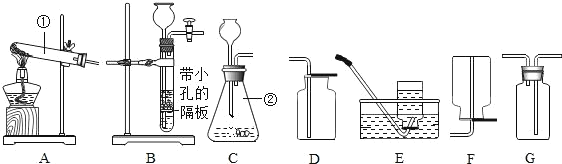
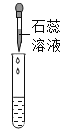
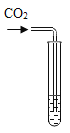
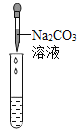
(实验探究)为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
实验现象 | ___________ | ___________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
(得出结论)通过探究,全班同学一致确定猜想III是正确的。
(评价反思)
(1) 丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因_____________________。
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑_____________________。
(反思交流)
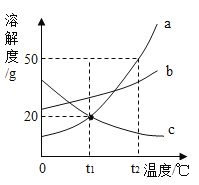
(3) 某同学在进行酸碱中和滴定实验时,测得溶液的pH变化如图所示,请回答下列问题:
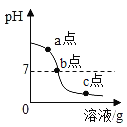
①由图可知,在c点处溶液中溶质是____________________。
②若要使c点对应的溶液变成b点对应的溶液,需要除去杂质,其中的一种方法是向烧杯中加入过量的____________________,过滤,除杂。